
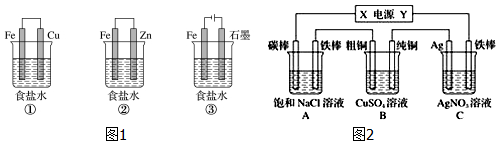
分析 (1)工业上冶炼铝是电解熔融的氧化铝得到;
(2)电池总反应为4Al+3O2+6H2O═4Al(OH)3,原电池中铝失电子做负极被氧化;
(3)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护,称为牺牲阳极的阴极保护法;③装置为电解池,铁做阴极被保护,根据电极的腐蚀速率关系来判断;
(4)如图2所示,若电解5min时C池中铁棒质量增加2.16g,则铁棒为阴极,Ag电极为阳极,依次纯铜做阴极,粗铜做阳极,A中铁棒做阴极,碳棒做阳极,X为正极,Y为负极,据此书写电极反应,结合电解过程中电极上电子守恒计算.
解答 解:(1)工业上冶炼铝的化学方程式是:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,
故答案为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
(2)我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O═4Al(OH)3,铝做负极失电子被氧化,则负极反应式为:Al-3e-=Al3+,
故答案为:Al-3e-=Al3+;
(3)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;①组装置中铁电极腐蚀最快,正极反应是氧气得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-;②中负极上金属锌失电子,电极反应为:Zn-2e-=Zn2+,金属铁被保护,此时金属铁可以采牺牲阳极的阴极保护法,装置③中发生的是电解饱和食盐水的反应,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子发生还原反应,阴极铁被保护,
故答案为:①;②③;
(4)如图2所示,若电解5min时C池中铁棒质量增加2.16g,则C中铁棒为阴极,电极反应为:Ag++e-=Ag,增大的质量为析出银的质量,物质的量=$\frac{2.16g}{108g/mol}$=0.02mol,电子转移总物质的量为0.02mol,Ag电极为阳极,电极反应为:Ag-e-=Ag+,C池为电镀池电解质溶液中溶质浓度不变,
分析判断,B装置中依次纯铜做阴极,电极反应为Cu2++2e-=Cu,粗铜做阳极,电极反应为Cu-2e-=Cu2+,A装置中铁棒做阴极,电极反应为:2H++2e-=H2↑,碳棒做阳极,电极反应为:2Cl--2e-=Cl2↑,X为正极,Y为负极,
故答案为:负极; 0.02mol; 2Cl--2e-=Cl2↑;Cu-2e-=Cu2+;不变.
点评 本题考查了金属腐蚀与防护的方法和应用、原电池和电解池的工作原理应用知识,注意原电池电极反应书写方法是基础,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 试剂 | 保存方法 | 理由 |
| A | 水玻璃 | 存放在带橡皮塞的细口瓶中,密封 | 防止与空气接触被氧化和与二氧化碳接触而变质 |
| B | 硫酸亚铁晶体 | 存放在带玻璃塞的广口瓶中,密封 | 防止与空气接触被氧化 |
| C | 浓硫酸 | 密闭保存 | 防止吸水和挥发 |
| D | 新制的溴水 | 存放在无色试剂瓶中,密封 | 防止挥发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的电离方程式:H2SO4=H2++SO42- | |
| B. | 光导纤维主要成分的化学式:Si | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 钠离子的结构示意图: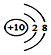 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
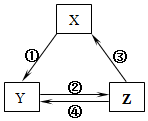 表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )
表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
| B | Na | Na2O2 | NaCl | ②加H2O |
| C | NO | NO2 | HNO3 | ③与C加热 |
| D | Al2O3 | NaAlO2 | Al(OH)3 | ④与NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、O3是同一种单质 | |
| B. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| C. | 正丁烷和异丁烷互为同系物 | |
| D. | 乙醇、乙醚互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com