
| A. | 0.1 mol 的11B中,含有0.6NA个中子 | |
| B. | pH=1的H3PO4溶液中,含有0.1NA个H+ | |
| C. | 2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 | |
| D. | 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P-Cl键 |
分析 A.B的质子数为5,11B中含有中子数=质量数-质子数=11-5=6;
B.缺少溶液体积,无法计算氢离子数目;
C.标况下苯的状态不是气体;
D.该反应为可逆反应,反应物不可能完全转化成生成物.
解答 解:A.11B中含有中子数=11-5=6,0.1 mol 的11B中含有0.6mol中子,含有0.6NA个中子,故A正确;
B.没有告诉pH=1的H3PO4溶液的体积,无法计算溶液中含有氢离子的物质的量就数目,故B错误;
C.标准状况下苯不是气体,不能使用标况下的气体摩尔体积计算,故C错误;
D.PCl3与Cl2生成PCl5的反应为可逆反应,则生成PCl5的物质的量小于1mol,增加的P-Cl键小于2NA,故D错误;
故选A.
点评 本题考查阿伏伽德罗常数的计算与判断,题目难度不大,明确标况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与其它物理量之间的关系,B为易错点,注意缺少溶液体积.


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
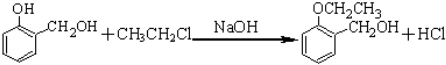 .
.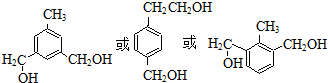 (写出一种
(写出一种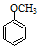 +HBr→
+HBr→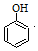 +CH3Br
+CH3Br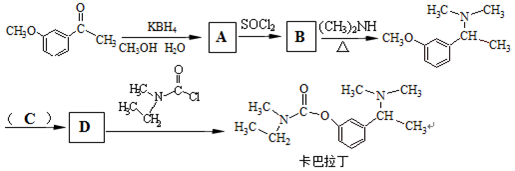
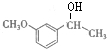 B:
B: C:HBrD:
C:HBrD: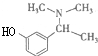 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol 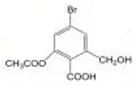 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,最多消耗这三种物质的物质的量分别是2mol、5mol、1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,最多消耗这三种物质的物质的量分别是2mol、5mol、1mol | |
| B. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别 | |
| C. | 乳酸薄荷醇酯(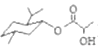 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| D. | 与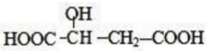 具有官能团种类及数目相同的同分异构体有2种 具有官能团种类及数目相同的同分异构体有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )| A. | Ka2(H2X)的数量级为10-6 | |
| B. | 曲线N表示pH与lg$\frac{c(H{X}^{-})}{c({H}_{2}X)}$的变化关系 | |
| C. | NaHX溶液中c(H+)>c(OH-) | |
| D. | 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
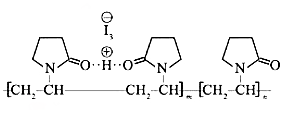 (图中虚线表示氢键)
(图中虚线表示氢键)| A. | 聚维酮的单体是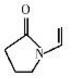 | |
| B. | 聚维酮分子由(m+n)个单体聚合而成 | |
| C. | 聚维酮碘是一种水溶性物质 | |
| D. | 聚维酮在一定条件下能发生水解反应 |
查看答案和解析>>
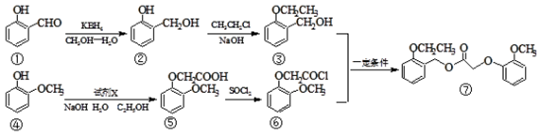
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:H2O>NH3>SiH4 | |
| B. | 氢元素与其他元素可形成共价化合物或离子化合物 | |
| C. |  如图所示实验可证明元素的非金属性:Cl>C>Si | |
| D. | 用中文“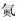 ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较3 0min时变浅 |
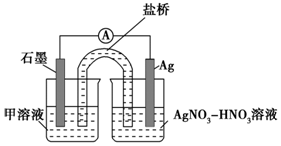
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a和b都属于芳香族化合物 | |
| B. | a和c分子中所有碳原子均处于同一平面上 | |
| C. | a、b和c均能使酸性KMnO4溶液褪色 | |
| D. | b和c均能与新制的Cu(OH)2反应生成红色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com