
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
���𰸡� C6H12O3 4 ��ȥ��Ӧ ������Ӧ ![]()
 AC
AC
��������
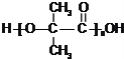
(1)���ݽṹ���ж�2-�ǻ��춡�������ķ����к���3������1��CH2ԭ���š�1���ǻ���1���������ʿ�֪����ʽΪC6H12O3�����ݷ��ӵĽṹ��֪����������4�ֲ�ͬ��ѧ������Hԭ�ӣ��ʴ�Ϊ��C6H12O3��4��
(2)���ݷ�Ӧ���̿�֪AΪ2-�ǻ��춡�ᣬ������ȥ��Ӧ����DΪ2-����ϩ�BΪ�Ҵ�������������ˮ�����ɣ�GΪ��ȩ����������Һ����������Ӧ�������ᣬHΪ���ᣬ�ʴ�Ϊ����ȥ��Ӧ��������Ӧ��
(3)�������ڼ���������ˮ�������Ҵ����ʴ�Ϊ��![]() ��
��
(4)2-�ǻ��춡���мȺ����Ȼ����ֺ����ǻ�����һ�������¿ɷ������۷�Ӧ����FΪ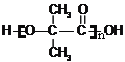 ���ʴ�Ϊ��
���ʴ�Ϊ��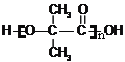 ��
��
(5)A������FeCl3��Һ����ɫ�����л�����Ӧ���з��ǻ�����A��ȷ��B����NaHCO3��Һ��Ӧ�ų�CO2��Ӧ�����Ȼ���ǰ���ޣ���B����C��ǰ�ߺ������������ߺ����Ȼ��ͷ��ǻ����������������Ʒ�Ӧ��1molǰ������1molNaOH����������2molNaOH����C��ȷ��D��ǰ�߲��������������ӳɷ�Ӧ����D����ѡAC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NaHSO3��������Һ���ᾧ��ˮ�ɵ�Na2S2O5������Ĥ��⼼���������Ʊ�Na2S2O5,װ����ͼ��ʾ,����SO2������Һ�к���NaHSO3��Na2SO3������˵������ȷ����
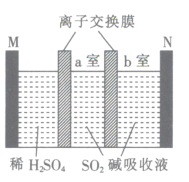
A.M����
B.���ӽ���Ĥ��Ϊ�����ӽ���Ĥ
C.������ӦʽΪ2H2O-4e-=4H++O2��
D.�����b������Na2S2O5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O����Ϊ��Ц������Ҳ��һ���������塣�����ѧ֪ʶ���ش��������⣺
(1)п�뼫ϡ���ᷴӦ������N2O���÷�Ӧ�Ļ�ѧ����ʽΪ___________������������������������뷴Ӧ����������ʵ���֮��Ϊ___________��
(2)��֪�������ʵ�����������£�
���� | N2O(g) | CO(g) | N2(g) | CO2(g) |
�������/kJmol-1 | 475.5 | 283.0 | 393.5 | 0 |
��N2O(g)��CO(g)��Ӧ����N2(g)��CO2(g)���Ȼ�ѧ����ʽΪ____________��
���������������䣬�����Ч�������÷�Ӧ���ʱ佫_______(����������������С������������)��
(3)�������ܴ�N2O�ķֽ⣬��Ӧ����(����)���£�
i.I2(g)2I(g)
ii.I(g)��N2O(g)��N2(g)��IO(g)
iii.2IO(g)��2N2O(g)��2N2(g)��2O2(g)��I2(g)
ʵ��������ڷ�Ӧ����c(I)ʼ�մ���c(IO)���ɴ��Ʋ⣬��Ӧ����ii_________iii(����>������<����������)��
(4)һ���¶��£�������ܱ������г���2 mol N2O(g)��3 mol NO(g)��������Ӧ��N2O(g)��NO(g)N2(g)��NO2(g) ��H�����N2����������¶ȡ�ʱ��Ĺ�ϵ��ͼ��ʾ��
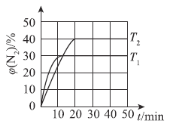
�١�H___________0(����>������<����������)��
��������������÷�Ӧ�ﵽƽ��״̬����___________(����ĸ)��
A.���������ܶȲ��ٸı� B.��Է����������ٸı�
C.NO��NO2������������� D.N2O������������ٸı�
��T1ʱ���÷�Ӧ��ƽ�ⳣ��K��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ����������
A.��ɫ����Һ��K+��H+��MnO4-��SO32-
B.0.1mol/LCuSO4��Һ��Mg2+��Al3+��NO3-��C1-
C.![]() =1��1013mol/L��Һ��K+��Fe2+��SCN-��NO3-
=1��1013mol/L��Һ��K+��Fe2+��SCN-��NO3-
D.�����������Ӧ����H2����Һ��Na+��NH4+��CO32-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����������Ӧ���۾���ȷ����
ѡ�� | ���� | ���� | ���� |
A | �����½�AlƬ����Ũ������ | �����Ա仯 | Al��Ũ�����Ӧ |
B | ��ij��Һ����μ������� | ������ɫ��ζ���� | ����Һ�к��� |
C | ��ij��Һ�еμ�ϡNaOH��Һ����ʪ��ĺ�ɫʯ����ֽ�����Թܿ� | ��ֽ������ | ԭ��Һ���� |
D | ����ij��Һ����μ����Ȼ�����Һ���ټ�ϡ���� | �а�ɫ�����������ҳ������ܽ� | ����Һ��һ������ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Cl��ʵ���ҳ����Լ����������˵����ȷ����
A.��Ӧ2NH4Cl(s)+Ba(OH)2(s)=BaCl2(s)+2NH3(g)+2H2O(s)����H>0����S<0
B.0.1mol��L��1NH4Cl��Һ��15C���µ�25��Cʱ��![]() ��ֵ����
��ֵ����
C.��ӦNH4Cl+NaNO2=NaCl+N2��+2H2O��ÿ����1molN2ת�Ƶ�����Ϊ6��6.02��1023
D.�����£�Ksp[Mg(OH)2]=1.8x10-11��Kb(NH3��H2O)=1.8x10-5��NH4Cl������Һ�м�������Mg(OH)2�����������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״�������ֵ����ʵ����Ŀ�ȼ�����干1.68L������һ����������������������ȫȼ�ա���������ͨ����������ʯ��ˮ���õ��İ�ɫ��������Ϊ15.0g������������ʯ������ȼ�ղ������9.3g���������ֻ���������Ϊ
A.H2��C4H6B.CO��C2H4C.CO��C3H6D.H2��C2H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ��ˮ��ʯ(þ�����ļ�ʽ̼����)�Ǿ��в�״�ṹ�������ܲ��ϣ�����Mg(NO3)2��6H2O��Fe(NO3)3��9H2O��CO(NH2)2�Ȱ�һ���������¶ȸ���90��ʱ��Ӧ�Ƶá�
(1)������������ʱ��n[CO(NH2)2]/n(Fe3+)��þ��ˮ��ʯ���ʺ���ҺpH�ı仯��ϵ��ͼ��ʾ��
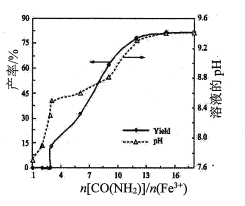
��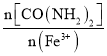 <3����ӦҺ�в����������壬�ⰱ��δ���NH3��˵���ݳ���������Ҫ��____________(�ѧʽ)��
<3����ӦҺ�в����������壬�ⰱ��δ���NH3��˵���ݳ���������Ҫ��____________(�ѧʽ)��
��n[CO(NH2)2]/n(Fe3+)>12����Һ��pH�����ȶ�״̬��������Ϊ_________________
(2)þ��ˮ��ʯ��ʾΪ��[FexMgy(OH)z](CO3)w��pH2O(Ħ������Ϊ660g��mol-1)����ͨ������ʵ�����������ȷ���仯ѧʽ���������£�
I��ȡþ��ˮ��ʯ3.300g��������ϡ�����ַ�Ӧ���ռ�������112mL(��״��)��
II�����ײ��þ��ˮ��ʯ�ȷֽ�TG-DSCͼ��303~473K��ʧȥ���ˮ(�ᾧˮ)ʧ��Ϊ10.9%��473~773Kʱ��CO32-��OH-�ֽ�ΪCO2��H2O��773K���ϲ���ΪMgO��Fe2O3��
��ȡ0.4000g�ȷֽ����(773K����)���ڵ���ƿ�У������Թ�������ʹ����ȫ�ܽ⣬��������ˮ���Թ�����KI��Һ���ڰ�������Ƭ�̣���0.1000mol��L-1Na2S2O3����Һ�ζ�����Һ�ʵ���ɫ������3mL������Һ�������ζ�����Һ��ɫ��ʧ��(2Na2S2O3+I2=2NaI+Na2S4O6)������Na2S2O3��Һ20.00mL��ͨ������ȷ��þ��ˮ��ʯ�Ļ�ѧʽ______________(д���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڷ���ȱ����ƶѪ������Ч�ɷ�һ��Ϊ�������������������������������������������ȡ��ش��������⣺
��1���ܱ�ʾ������͵��������ӵĵ����Ų�ʽ��_________�����ţ���
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
��2�������ἴ������(HOOCCH2CH2COOH)��������������е縺������ԭ����_____��̼ԭ�ӵ��ӻ���ʽ��______�������������д�����λ�����ڸ���λ������λԭ����____������ԭ����____��
��3��������������ụΪ˳���칹�壬����볣�����±���
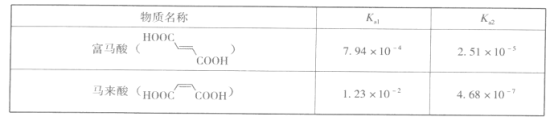
�������ĽǶȽ��������������볣������С�����������������볣�����ϴ��ԭ��____��
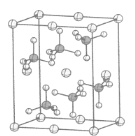
��4����-���������ľ����ṹ��ͼ��ʾ���侧������Ϊa= 870 pm��b=680 pm��c=479 pm����=��=��=90�㣬Fe2+ռ�ݾ������㡢���ġ����ĺ����ġ��ڸþ����У�����������ڿռ�����____�ֿռ�ȡ����������������ӵĸ�����____����ԭ����Χ�������ԭ�ӵĸ���Ϊ____���谢���ӵ�������ֵΪNA����þ�����ܶ���____ g��cm-3���г��������ʽ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com