
����Ŀ���¶�ΪTʱ����4.0L�����ܱ������г���2.0mol PCl5 �� ������Ӧ��PCl5��g��PCl3��g��+Cl2��g������Ӧʱ�䣨t����������������ѹǿ��p�������ݼ�����
t/s | 0 | 50 | 150 | 250 | 350 |
��ѹǿp/100kPa | 100 | 116 | 119 | 120 | 120 |
��1������ѹǿp����ʼѹǿp0���㷴Ӧ��PCl5��ת���ʦ���PCl5���ı���ʽΪ��ƽ��ʱPCl5��ת����Ϊ���٣�
��2����Ӧ��ǰ50s��ƽ������v��PCl3��Ϊ���٣�
��3�����¶��µ�ƽ�ⳣ��Ϊ���٣�
���𰸡�
��1���⣺���º��������£���Ӧǰ������ѹǿ֮�ȵ��������ʵ���֮�ȣ����ݱ�������֪����Ӧ��250sʱ�ﵽƽ��״̬�����ݷ���ʽ֪����Ӧǰ����������ʵ����൱�ڲμӷ�ӦPCl5�����ʵ��������Է�Ӧǰ�������ѹǿ�൱�ڲμӷ�Ӧ��PCl5��ѹǿ��PCl5��ת���ʦ���PCl5��= ![]() ��100%��PCl5��ת����=
��100%��PCl5��ת����= ![]() ��100%=20%��
��100%=20%��
������ѹǿp����ʼѹǿp0���㷴Ӧ��PCl5��ת���ʦ���PCl5���ı���ʽΪ ![]() ��100%��ƽ��ʱPCl5��ת����Ϊ20%��
��100%��ƽ��ʱPCl5��ת����Ϊ20%��
��2���⣺ǰ50sPCl5��ת����= ![]() ��100%=16%����μӷ�Ӧ��n��PCl5��=2.0mol��16%=0.32mol�����ݷ���ʽ֪���μӷ�Ӧ��n��PCl5���������ɵ�n��PCl3��=0.32mol����Ӧ��ǰ50s��ƽ������v��PCl3��=
��100%=16%����μӷ�Ӧ��n��PCl5��=2.0mol��16%=0.32mol�����ݷ���ʽ֪���μӷ�Ӧ��n��PCl5���������ɵ�n��PCl3��=0.32mol����Ӧ��ǰ50s��ƽ������v��PCl3��= ![]() =
= ![]() =0.0016mol/��Ls����
=0.0016mol/��Ls����
�𣺷�Ӧ��ǰ50s��ƽ������v��PCl3��Ϊ0.0016mol/��Ls����
��3���⣺�ﵽƽ��״̬ʱ�����Ȼ���ת����= ![]() ��100%=20%����μӷ�Ӧ��n��PCl5��=2.0mol��20%=0.4mol�����ɵ�n��PCl3��=n��Cl2��=0.4mol��ʣ���n��PCl5��=2.0mol��0.4mol=1.6mol��
��100%=20%����μӷ�Ӧ��n��PCl5��=2.0mol��20%=0.4mol�����ɵ�n��PCl3��=n��Cl2��=0.4mol��ʣ���n��PCl5��=2.0mol��0.4mol=1.6mol��
��ƽ��ʱc��PCl3��=c��Cl2��= ![]() =0.1mol/L��c��PCl5��=
=0.1mol/L��c��PCl5��= ![]() =0.4mol/L��
=0.4mol/L��
��ѧƽ�ⳣ��K= ![]() =
= ![]() mol/L=0.025mol/L��
mol/L=0.025mol/L��
�𣺸÷�Ӧ��ѧƽ�ⳣ��KΪ0.025mol/L��
����������1�����º��������£���Ӧǰ������ѹǿ֮�ȵ��������ʵ���֮�ȣ����ݱ�������֪����Ӧ��250sʱ�ﵽƽ��״̬�����ݷ���ʽ֪����Ӧǰ����������ʵ����൱�ڲμӷ�ӦPCl5�����ʵ��������Է�Ӧǰ�������ѹǿ�൱�ڲμӷ�Ӧ��PCl5��ѹǿ���ݴ�ȷ��PCl5��ת���ʦ���PCl5���ı���ʽ������PCl5��ת���ʣ���2��ǰ50sPCl5��ת����= ![]() ��100%=16%����μӷ�Ӧ��n��PCl5��=2.0mol��16%=0.32mol�����ݷ���ʽ֪���μӷ�Ӧ��n��PCl5���������ɵ�n��PCl3��=0.32mol����Ӧ��ǰ50s��ƽ������v��PCl3��=
��100%=16%����μӷ�Ӧ��n��PCl5��=2.0mol��16%=0.32mol�����ݷ���ʽ֪���μӷ�Ӧ��n��PCl5���������ɵ�n��PCl3��=0.32mol����Ӧ��ǰ50s��ƽ������v��PCl3��= ![]() ����3���ﵽƽ��״̬ʱ�����Ȼ���ת����=
����3���ﵽƽ��״̬ʱ�����Ȼ���ת����= ![]() ��100%=20%����μӷ�Ӧ��n��PCl5��=2.0mol��20%=0.4mol�����ɵ�n��PCl3��=n��Cl2��=0.4mol��ʣ���n��PCl5��=2.0mol��0.4mol=1.6mol����ƽ��ʱc��PCl3��=c��Cl2��=
��100%=20%����μӷ�Ӧ��n��PCl5��=2.0mol��20%=0.4mol�����ɵ�n��PCl3��=n��Cl2��=0.4mol��ʣ���n��PCl5��=2.0mol��0.4mol=1.6mol����ƽ��ʱc��PCl3��=c��Cl2��= ![]() =0.1mol/L��c��PCl5��=
=0.1mol/L��c��PCl5��= ![]() =0.4mol/L����ѧƽ�ⳣ��K=
=0.4mol/L����ѧƽ�ⳣ��K= ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƣ�Na2S2O3���ǻ������ż���к����峣�õ�һ��ҩƷ����������ˮ�������ֽ⡣ijʵ����ģ�ҵ���ȡ��������ƣ��䷴Ӧװ�ü������Լ���ͼ��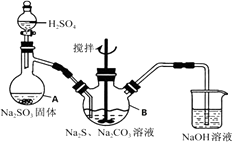
ʵ������������Ϊ��
�ٴ�Һ©��ʹ�����������£��ʵ����ڷ�Һ©���ĵ��٣�ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У�ͬʱ�����綯������������ˮԡ���ȣ��С�
��ֱ�������Ļ��Dz�����ʧ����������Һ��pH�ӽ�7ʱ��ֹͣͨ��SO2���塣
��1�������A��������
��2��д��A�з�����Ӧ�Ļ�ѧ����ʽ��
��3��Ϊ�˱�֤��������ƵIJ�����ʵ����ͨ���SO2���ܹ�����ԭ������
��4��Na2S2O3���������ȼ�������Һ���ױ�Cl2������SO42���ӣ��÷�Ӧ�����ӷ���ʽΪ��
��5��Ϊ����֤������������ƹ�ҵ��Ʒ�к���̼���ƣ�ѡ����ͼװ�ý���ʵ�顣
��ʵ��װ�õ�����˳������������װ�õ���ĸ���ţ���װ��C�е��Լ�Ϊ��
����֤�������к���̼���Ƶ�ʵ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������жϴ������
A. �ȶ��ԣ�H2O>NH3>CH4B. ԭ�Ӱ뾶��N<O<F
C. ���ԣ�HClO4>H2SO4>H3PO4D. ���ԣ�NaOH>Mg(OH)2>Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��ʯ����CuO��������ˮ��Cu2(OH) 2CO3 �� ������Fe2O3��FeO��SiO2�ȡ�ͭ�������������������Ԫ�ء�ij����������ͭ�����������������£�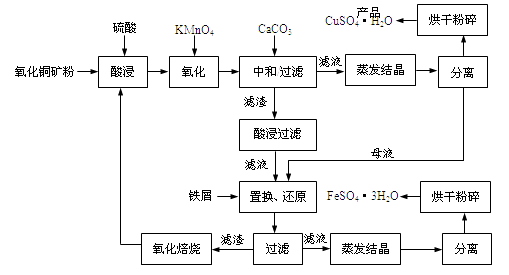
��1������ͭ��ʯ�����Ŀ����,KMnO4�������ǽ�Fe2+������Fe3+��
��2��д�����������Cu2(OH) 2CO3������Ӧ�����ӷ���ʽ ��
��3�����к�/���ˡ��м���CaCO3��Ŀ����,ʹFe3+ ˮ��ɳ�������ȥ��
��4�������жദ�漰�����ˡ���ʵ�����й�����Ҫʹ�õIJ����������ձ�����
��5��������м��������ʹĸҺ��Fe3+ת��ΪFe2+����
��6���±�Ϊ����ͭ���塰��ɷ��顱����������
����mΪCuSO4��5H2O�����������xΪ��������þ����нᾧˮ�������ݴ˿�ȷ����CuSO4��5H2O��ˮ��������ʾ��Ʒ�����˹�������Ϊ��ָ���������¶Ⱥ�ʱ�䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����18�֣��ó����ζ������ٲⶨNaI�ȵ⻯����Һ��c(I)��ʵ����̰���������Һ�͵ζ�������Һ�� ��������Һ
a��ȷ��ȡAgNO3����4.2468 g��0.0250 mol�������Ƴ�250 mL����Һ��������ɫ�Լ�ƿ�бܹⱣ�棬���á�
b�����Ʋ��궨100 mL 0.1000 mol��L1 NH4SCN����Һ�����á�
�ζ�����Ҫ����
a��ȡ����NaI��Һ25.00 mL����ƿ�С�
b������25.00 mL 0.1000 mol��L1 AgNO3��Һ����������ʹI��ȫת��ΪAgI������
c������NH4Fe(SO4)2��Һ��ָʾ����
d����0.1000 mol��L1NH4SCN��Һ�ζ�������Ag+ �� ʹ��ǡ����ȫת��ΪAgSCN��������ϵ���ֵ���ɫ��ֹͣ�ζ���
e���ظ������������Ρ����βⶨ�������±���
ʵ����� | 1 | 2 | 3 |
����NH4SCN����Һ���/mL | 10.24 | 10.02 | 9.98 |
f�����ݴ�����
�ش��������⣺
��1�����Ƶõ�AgNO3���Ƴɱ���Һ����ʹ�õ��������ձ��Ͳ����������
��2��AgNO3����Һ������ɫ�Լ�ƿ�бܹⱣ���ԭ������
��3���ζ�Ӧ��pH��0.5�������½��У���ԭ������
��4��b��c���������Ƿ���Եߵ� �� ˵��������
��5�������ĵ�NH4SCN����Һƽ�����ΪmL�����c(I-)=mol��L-1��
��6���ڵζ�����װ��NH4SCN����Һ��ǰһ����Ӧ���еIJ���Ϊ��
��7���ж����в�����c(I-)�ⶨ�����Ӱ�죨�ƫ�ߡ�����ƫ�͡�����Ӱ�족�� ����������AgNO3����Һʱ���ձ��е���Һ��������������ⶨ�����
�����ڵζ��յ��ȡ�ζ��̶ܿ�ʱ�����ӱ�ҺҺ�棬��ⶨ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��̬����������ܶȸߡ��ɱ��ͣ��乤��ԭ����ͼ��ʾ�����е缫a���ò���ʯīϩ��S8���ϣ���ط�ӦΪ��16Li+xS8=8Li2Sx��2��x��8��������˵��������ǣ� �� 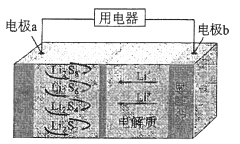
A.��ع���ʱ�������ɷ�����Ӧ��2Li2S6+2Li++2e-=3Li2S4
B.��ع���ʱ�����·������0.02 mol���ӣ��������ϼ���0.14 g
C.ʯīϩ��������Ҫ����ߵ缫a�ĵ�����
D.��س��ʱ��Խ��������е�Li2S2��Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����17�֣��Ǽ��㶹����һ�����Ƶ���ʯ��ҩ��ϳ�·������ͼ��ʾ��


��֪�� 
RCOOR'+R'OH ![]() RCOOR'+ R'OH��R��R'��R'����������
RCOOR'+ R'OH��R��R'��R'����������
��1��A���ڷ���������ṹ��ʽ����B�������Ĺ���������
��2��C��D�ķ�Ӧ��������
��3��E����֬�ࡣ�����Ҵ�Ϊ�л�ԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�E��д���йػ�ѧ����ʽ����
��4����֪��2E ![]() F+C2H5OH��F������������
F+C2H5OH��F������������ ![]() ����
����
��5����D��FΪԭ�Ϻϳ��Ǽ��㶹�ط�Ϊ������Ӧ��д���йػ�����Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͬ�����������ֱ�Ͷ��������ϡ���������������Һ�У���ַ�Ӧ����������������� ��
A.���������������
B.������������Һ����������
C.���߲�������һ����
D.���ж�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com