
 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:分析 (1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
(3)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大;
(4)要使醋酸根离子浓度增大,可以采用加热、加入含有醋酸根离子的物质、加入和氢离子反应的物质;
(5)对0.1mol/l的稀醋酸加水稀释,电离平衡向正反应方向移动,平衡常数只与温度有关,据此分析.
解答 解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,
故答案为:无自由移动的离子;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,
故答案为:b<a<c;
(3)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,所以氢离子物质的量最大的是c,
故选c;
(4)要使醋酸根离子浓度增大,可以采用加热、加入含有醋酸根离子的物质、加入和氢离子反应的物质,
A.加热促进醋酸电离,则溶液中醋酸根离子浓度增大,故正确;
B.加很稀的NaOH溶液,促进醋酸电离,但溶液的体积增大,导致醋酸根离子浓度减小,故错误;
C.加NaOH固体,氢氧化钠和氢离子反应促进醋酸电离,所以醋酸根离子浓度增大,故正确;
D.加水稀释能促进醋酸电离,但醋酸根离子浓度减小,故错误;
E.加固体CH3COONa,能抑制醋酸电离,但醋酸钠电离出的醋酸根离子大于抑制醋酸电离出的醋酸根离子,所以醋酸根离子浓度增大,故正确;
F.加入锌粒,和氢离子反应,促进醋酸电离,所以醋酸根离子浓度增大,故正确;
故选ACEF;
(5)A.K电离(CH3COOH)只与温度有关,温度不变时,K电离(CH3COOH)不变,故A错误;
B.Kw只与温度有关,温度不变时,Kw不变,故B错误;
C.稀醋酸加水稀释,溶液的酸性减弱,c(H+)变小,故C错误;
D.稀醋酸加水稀释,溶液的酸性减弱,c(H+)变小,则c(OH-)变大,故D正确;
E.稀醋酸加水稀释,电离平衡向正反应方向移动,所以$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故E正确;
故选DE.
点评 本题考查电解质的电离,题目难度中等,易错选项是D,加水稀释醋酸,能促进醋酸电离,但溶液中醋酸根离子增大的量远远小于水体积增大的量,所以醋酸根离子浓度减小,为易错点.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:CO32-、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:NH4+、K+、CH3COO-、Cl- | |
| C. | pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3- | |
| D. | 水电离的c(H+)=10-12 mol/L的溶液中:Fe3+、SO42-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4的摩尔质量为16 | |
| B. | 1molH2O的质量为18g/mol | |
| C. | H2的气体摩尔体积约为22.4L | |
| D. | 在标准状况下,22.4 L由N2、N2O组成的混合气体的物质的量约1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ①④⑤ | C. | ①④⑦ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3在反应中得到电子 | B. | O2在反应中失去电子 | ||
| C. | NO是反应的还原产物 | D. | 1mol氧化剂在反应中得到4mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
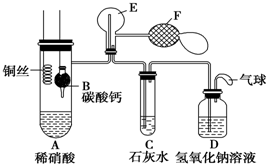 Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1000 | 1500 |
| C(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2 | |
| D. | 平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时C(N2O5)>5.00mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com