
 .
.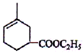 .
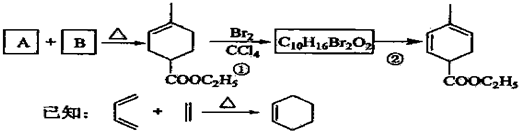
. 分析 化合物A是合成天然橡胶的单体,分子式为C5H8,A是异戊二烯,A和B反应生成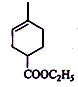 ,根据异戊二烯和
,根据异戊二烯和 的结构简式知,A和B发生了加成反应,B的结构简式为CH2=CHCOOCH2CH3,
的结构简式知,A和B发生了加成反应,B的结构简式为CH2=CHCOOCH2CH3, 和溴发生加成反应生成
和溴发生加成反应生成 ,
, 和氢氧化钠的醇溶液发生消去反应生成
和氢氧化钠的醇溶液发生消去反应生成 ,据此答题.
,据此答题.
解答 解:化合物A是合成天然橡胶的单体,分子式为C5H8,A是 CH2=C(CH3)CH=CH2,A和B反应生成 ,根据异戊二烯和
,根据异戊二烯和 的结构简式知,A和B发生了加成反应,B的结构简式为:CH2=CHCOOCH2CH3,
的结构简式知,A和B发生了加成反应,B的结构简式为:CH2=CHCOOCH2CH3, 和溴发生加成反应生成
和溴发生加成反应生成 ,
, 和氢氧化钠的醇溶液发生消去反应生成
和氢氧化钠的醇溶液发生消去反应生成 ,
,
(1)根据上面的分析可知,A是 CH2=C(CH3)CH=CH2,A的名称是2-甲基-1,3-丁二烯(或异戊二烯),B的结构简式为CH2=CHCOOCH2CH3,
故答案为:2-甲基-1,3-丁二烯(或异戊二烯);CH2=CHCOOCH2CH3;
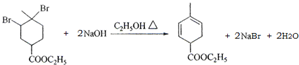
(2)②的反应为 与氢氧化钠的醇溶液发生消去反应生成
与氢氧化钠的醇溶液发生消去反应生成 ,反应的化学方程式为
,反应的化学方程式为 ,
,
故答案为: ;
;
(3)A是 CH2=C(CH3)CH=CH2,A的同分异构体中属于炔烃的异构体有CH≡CCH2CH2CH3、CH3C≡CCH2CH3、CH≡CCH(CH3)2,共3种,故答案为:3;
(4)A、B发生加成反应,A是不对称二稀,所以还可以生成一个六元环化合物的结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断,题目难度中等,正确理解题干信息及合成流程为解答本题的关键,熟练掌握常见有机物结构与性质为解答此类题的基础,试题涉及的知识点较多,综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识能力.


科目:高中化学 来源: 题型:选择题
| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 | |
| C. | 氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 | |
| D. | 可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是制造太阳能电池的常用材料 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 氢氟酸可用刻蚀玻璃 | |
| D. | 硅是制取水泥的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-戊烯的同分异构体数目为五种 | |
| B. | 丙烯与HCl加成产物是1-氯丙烷 | |
| C. | 组成为CnH2n的烃,当n=4时,才具有同分异构体 | |
| D. | 能使溴水或酸性KMnO4溶液褪色的C4H8的物质可能有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com