
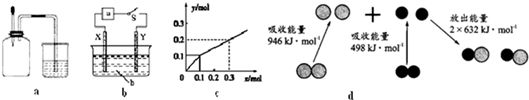
| A. | 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ | |
| D. | 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=-180 kJ/mol |
分析 A.生成的一氯甲烷不溶于水;
B.X为铁棒,X极附近产生白色沉淀时,可知Fe为阳极失去电子,电子从负极流向正极;
C.通过0.2mol电子时生成0.1molY,则应该是氢离子放电,而N3+不放电,氧化性最弱;
D.由图可知,反应热=946kJ/mol+498 kJ/mol-2×632kJ/mol=180 kJ/mol,以此来解答.
解答 解:A.由于甲烷与氯气的反应中可能产生一氯甲烷气体,而一氯甲烷不溶于水,则水不可能充满集气瓶,故A错误;
B.X极附近产生白色沉淀,这说明X电极是铁电极,与电源的正极相连,作阳极失去电子转化为亚铁离子,因此电子从X极流入a,故B正确;
C.根据图象可知通过0.1mol电子时产生0.1molY,这说明应该是M+放电.再通过0.2mol电子时生成0.1molY,则应该是氢离子放电,所以离子氧化能力M+>H+>N3+,故C错误;
D.图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,氮气含有三键,键能大于氧气中键能,则N≡N的键能为946kJ/mol,反应热=946kJ/mol+498 kJ/mol-2×632kJ/mol=180 kJ/mol,所以热化学方程式为N2(g)+O2(g)=2NO(g)△H=+180 kJ/mol,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、电解原理、热化学反应为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4 个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI溶液在空气久置变黄:4I-+O2+4H+=2I2+2H2O | |
| B. | 用稀盐酸除去久存石灰水的烧杯内壁上的固体:2H++Ca(OH)2=Ca2++2H2O | |
| C. | 用酸性KMnO4溶液除去CO2中SO2:3SO2+2MnO4-+4H+=3SO42-+2MnO2↓+H2O | |
| D. | 用足量饱和Na2CO3溶液吸收制备的乙酸乙酯:CO32-+CH3COOH=HCO3-+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学变化的同时总伴随着能量变化 | |
| B. | 需加热才反应的一定是吸热反应 | |
| C. | 在常温下就能进行的反应一定是放热反应 | |
| D. | 反应物的总能量大于生成物的总能量的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
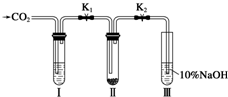 某课题研究小组的同学在查阅资料时得知,Na2O2与干燥的CO2不能发生反应,当有少量水存在时,Na2O2可与CO2发生反应生成Na2CO3和O2.为了探究“二氧化碳是否在有水存在时才能与过氧化钠反应”.某课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
某课题研究小组的同学在查阅资料时得知,Na2O2与干燥的CO2不能发生反应,当有少量水存在时,Na2O2可与CO2发生反应生成Na2CO3和O2.为了探究“二氧化碳是否在有水存在时才能与过氧化钠反应”.某课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 用装置①进行电镀,镀件接在b极上 | |
| C. | 装置①的a极为阴极 | |
| D. | 装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积不变,增加H2O(g)的量 | |
| B. | 保持体积不变,充入Ne使体系压强增大 | |
| C. | 将容器的体积缩小一半 | |
| D. | 压强不变,充入He使容器的体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 在铁的表面镀上一层锌,铁作阳极,电极反应式为:Zn2++2e-=Zn | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com