
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计的制备Na2S2O3·5H2O的装置和部分操作步骤如下。

Ⅰ.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液经过 、 、过滤、洗涤、烘干,得到产品Na2S2O3·5H2O。
①Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 (用离子方程式表示)。
②Ⅳ中,操作步骤是 、 。
③装置B中盛放的试剂是(填化学式) 溶液。
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因 。
(2)常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 0 mol·L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
编号 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准 |
|
|
|
|
溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
部分反应离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
则判断达到滴定终点的现象是 ,废水中Ba2+的物质的量浓度 _。
(1)①S2O32-+2H+=S↓+SO2↑+H2O ②蒸发浓缩 冷却结晶 ③NaOH
④浓硫酸浓度不够或铜被氧化或固体中含不与浓硫酸反应的杂质等合理答案均可
(2)加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变 9.6×10-4 mol·L-1
【解析】(1)制取Na2S2O3·5H2O的原理为SO2首先与C装置中的Na2CO3溶液反应生成Na2SO3,然后发生反应S+Na2SO3=Na2S2O3,过量的SO2会产生酸性环境,根据题意Na2S2O3在酸性条件下易发生反应S2O32-+2H+=S↓+SO2↑+H2O,一部分S2O32-反应时消耗H+可使溶液pH增大,最后过滤除去硫单质,将滤液蒸发浓缩、冷却结晶,过滤即可得Na2S2O3·5H2O。装置B的作用是处理尾气,其中所盛液体为NaOH溶液。
(2)平行测定的四组数据中有一组为“离群数据”,舍去,其他三组数据取平均值为18.00 mL。根据题意可得关系式:Ba2+~BaCrO4 ~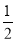 Cr2O72- ~
Cr2O72- ~ I2 ~3Na2S2O3。故废水中Ba2+的物质的量浓度为
I2 ~3Na2S2O3。故废水中Ba2+的物质的量浓度为
c(Ba2+)=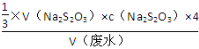 =
=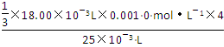 =9.6×10-4 mol·L-1。
=9.6×10-4 mol·L-1。


科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
在常温下,X2(g)和H2反应生成HX的平衡常数如表中所示,仅依据K的变化,关于等物质的量浓度的H2与X2的反应,下列说法正确的是( )
化学方程式 | 平衡常数K |
F2+H2 | 6.5×1095 |
Cl2+H2 | 2.6×1033 |
Br2+H2 | 1.9×1019 |
I2+H2 | 8.7×102 |
A.F2的转化率最大
B.X2与H2反应的剧烈程度逐渐减弱
C.X2与H2反应的反应速率依次减小
D.升高温度,平衡常数都增大
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能溶解Al2O3的溶液:Na+、K+、HCO3—、NO3—
B.0.1 mol·L-1Ca(ClO)2溶液:K+、Na+、I-、Cl-
C.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3—
D.加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.金刚石、碳化硅、晶体硅的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,每个CaO晶胞中含有4个Ca2+和4个O2-
C.设NaCl的摩尔质量为M g·mol-1,NaCl的密度为ρ g·cm-3,阿伏加德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为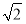 ·
·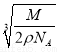 cm
cm
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的组成式为XY3
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:填空题
请回答下列化工生产中的一些问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填标号)。
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3 和SO2,该反应的化学方程式为 。
(3)为提高SO3吸收率,实际生产中通常用 吸收SO3。
(4)已知反应2SO2(g)+O2(g) 2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。
2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃ | 600 | 620 | 640 |
炉渣中CuSO4的质量数/% | 9.3 | 9.2 | 9.0 |
已知CuSO4 在低于660 ℃时不会分解,请简要分析上表中CuSO4 的质量分数随温度升高而降低的原因 。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用 (填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:实验题
一定浓度NaHCO3溶液与CuSO4溶液反应后生成了蓝绿色颗粒状沉淀。就沉淀成分提出了如下三种假设:
假设一:沉淀是CuCO3;假设二:沉淀是Cu(OH)2;
假设三:沉淀是CuCO3和Cu(OH)2的混合物。
(1)写出假设二,沉淀是Cu(OH)2生成的理由 (用离子方程式表示);
(2)为了探究沉淀的成分,取出了一部分沉淀,滴加稀盐酸,有气体放出。凭此现象,判断沉淀中含有 _;
(3)为了进一步探究沉淀的成分,进而确定假设中何种假设成立,设计实验,装置图如下:
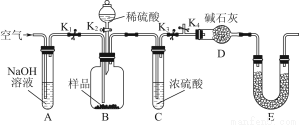
①研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 _ 、洗涤、干燥;
②装置E中药品的名称是 __作用为 __;
③实验过程中有以下操作步骤:a.打开K1、K3,关闭K2、K4,通入过量空气。此步骤的作用是 ;
b.关闭K1、K3,打开K2、K4,充分反应,c.再通入过量空气时,活塞处于打开的是 _,关闭的是 _。
④若沉淀样品的质量为m g,装置D的质量增加了n g;若沉淀样品为纯净物,m、 n之间的关系为 _
若假设三成立,则Cu(OH)2的质量分数为 _;若不进行步骤c,则会使测得结果 (填“偏高”“无影响”“偏低”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:选择题
下列化学实验事实及其解释都正确的是( )
①向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
②向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
③向0.1 mol/L FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
④向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
分析下列各项物质分子式的规律,按此规律排布第10项的分子式应为( )
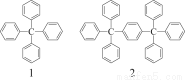
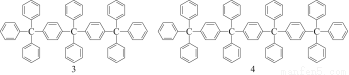
A.C198H146 B.C196H155 C.C196H146 D.C198H155
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:填空题
已知:氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①向其中加入适量的NaBiO3,溶液变为紫红色。②继续滴加适量H2O2,紫红色褪去,并有气泡产生。③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式:________________________________________。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________________。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是
________________________________________________________________________。
(4)若实验②放出了336 mL气体(标准状况),则反应①被氧化的Mn(NO3)2为________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com