
.在溶液中发生的反应,对反应速率不发生影响的因素是
A.温度 B.压强 C.浓度 D.催化剂
科目:高中化学 来源: 题型:
A、硫酸型酸雨的形成会涉及反应:2H2SO3+O2
| ||||
| B、明矾放入水中可形成带正电的Al(OH)3胶粒:Al3++3H2O?Al(OH)3(胶体)+3H+ | ||||
| C、选用CuSO4溶液除去乙炔气体中的H2S:H2S+Cu2+═CuS↓+2H+ | ||||
| D、热的纯碱液可以清洗油污的原因:CO32?+2H2O?H2CO3+2OH? |
查看答案和解析>>
科目:高中化学 来源:2014秋季甘肃省白银市高二第一学期期中理科化学试卷(解析版) 题型:填空题
(12分)工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g) ? CH3OH(g)
(1)下图表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,写出反应的热化学方程式 ;
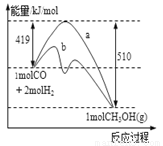
选择适宜的催化剂, (填“能”或“不能”)改变该反应的反应热。
(2)该反应平衡常数K的表达式为K= ,温度升高,平衡常数K (填“增大”、“不变”或“减小”);
(3)恒容条件下,下列措施中能使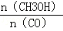 增大的有 。
增大的有 。
a.升高温度 b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂.
查看答案和解析>>
科目:高中化学 来源:2014秋季甘肃省高二第一学期期中考试文科化学试卷(解析版) 题型:选择题
长期吸食或注射毒品会危及人体健康,下列各组中都属于毒品的是
A.冰毒、青霉素 B.海洛因、阿司匹林
C.大麻、摇头丸 D.阿莫西林、尼古丁
查看答案和解析>>
科目:高中化学 来源:2014秋季湖南省高二上学期第一次阶段测试化学(B)试卷(解析版) 题型:选择题
反应2A+3B=C+2D在2L的密闭容器中进行,半分钟后,C的物质的量增加了0.3 mol,则此反应的平均速率表达正确的是
A.v(C)=0.01 mol·L-1·s-1
B.v(B)=0.03 mol·L-1·s-1
C.v(A)=0.01 mol·L-1·s-1
D.v(D)=0.02 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2014秋季湖南省高二上学期第一次阶段测试化学(B)试卷(解析版) 题型:选择题
在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应: A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是(其中只有B气体有颜色)
2C(气)+D(气)已达平衡状态的是(其中只有B气体有颜色)
A.混合气体的压强 B.混合气体的密度
C.气体的平均分子量 D.气体的颜色
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:填空题
(16分)在一定条件下,NO与NO2混合可生成N2O3 ,反应的化学方程式为:
NO(g)+NO2(g) N2O3(l) △H<0
N2O3(l) △H<0
下图表示一定量的NO、NO2混合气体发生反应时,N02浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。

(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向______ _移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:______,该反应的氧化剂是______________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数。下列有关叙述正确的是(Fe-56 O-16)( )
A.标准状况下,2.24LH2O含有的分子数等于0.1NA
B.5.6g Fe与足量稀盐酸反应,转移电子数为0.2 NA
C.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
D.18g重水(D2 O)所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市毕业班调研测试理综化学试卷(解析版) 题型:填空题
(16分)(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:甲醇脱水反应①2CH3OH(g) = CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g) = C2H4 (g)+2H2O(g)?△H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g) = CH3OCH3(g))? △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g) C2H5OH(g) △H= ;
C2H5OH(g) △H= ;
(2)乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图。结合曲线归纳平衡转化率-T曲线变化规律:
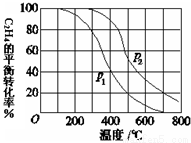
(a) ;
(b) ;
(3)若要进一步提高乙烯的转化率,可以采取的措施有 。
A.增大乙烯的浓度 B.分离出乙醇 C.加催化剂
(4)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,求x的值。(写出计算步骤)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com