
试分析下列各种情况下微粒间作用力的变化情况(填“离子键”“极性键”“非极性键”或“分子间作用力”):
①NaCl溶于水时破坏___________________________________;
②HCl溶于水时破坏____________________________________;
③SO2溶于水时破坏____________________________________;
④酒精溶于水时破坏____________________________________;
⑤NaOH和HCl反应时形成_______和_______;
⑥反应2H2+O22H2O中,被破坏的是________,形成的是________;
⑦CaCl2和Na2CO3反应时,被破坏的化学键有________,形成的化学键有________;
⑧Na2O熔化时被破坏的是________。
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.蛋白质在氧气中完全燃烧转化为水和二氧化碳 |
| B.淀粉和纤维素分子式均可表示成(C6Hl005)n,它们互为同分异构体 |
| C.与碱反应生成盐和水的氧化物均为酸性氧化物 |
| D.离子化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在下列物质中:①CO2 ②KOH ③He ④BaSO4 ⑤NaCl。其中只含有离子键的是(填序号,下同) ,既含有离子键又含有共价键的是 ,不含化学键的是 。
(2)下列物质在所述变化中:①烧碱熔化 ②HCl气体溶于水 ③NH4Cl受热分解 ④干冰升华。其中化学键未被破坏的是(填序号,下同) ,仅发生共价键破坏的是 ,既发生离子键破坏,又发生共价键破坏的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E → E-E; =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A; =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E; =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g); =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |  1 1 |  2 2 |  3 3 |
 ( A2)为 。
( A2)为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。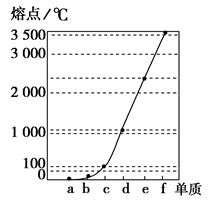
(1)请写出上图中d单质对应元素原子的电子排布式_________________________。
(2)单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子中含__________个σ键,__________个π键。
(3)a与b的元素形成的10电子中性分子X的空间构型为__________;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为____________,其中X与d的高价离子之间以____________键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为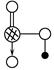 ,请简要说明该物质易溶于水的原因________________________________。
,请简要说明该物质易溶于水的原因________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)判断下列各对化合物中键的极性大小,并说明原因。ZnO和ZnS;HI和HCl;H2S和H2Se;H2O和OF2。
(2)某有机物分子的结构简式为 ,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。
,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。
(3)用电子式表示Cl2、NH3、H2S、CO2分子的形成过程。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W原子的核外电子排布式为_________。
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为_________、__________、_________,推测盐中阴离子的空间构型为__________,其中心原子杂化方式为__________。
(3)Z、W两种元素电负性的大小关系为____;Y、Z两种元素第一电离能的大小关系为____。
(4)CO的结构可表示为C O,元素Y的单质Y2的结构也可表示为Y
O,元素Y的单质Y2的结构也可表示为Y Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):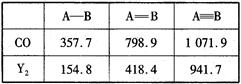
①结合数据说明CO比Y2活泼的原因:_____。
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是_____。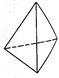
A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
判断下列四句话的对错,并且说出理由:
(1)离子键只存在于离子化合物中
(2)离子化合物一定含离子键
(3)离子化合物中一定不存在分子
(4)离子化合物不一定含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组物质的晶体中,化学键种类相同,晶体类型也相同的是
| A.MgO和BaO2 | B.SO2和SiO2 | C.KOH和NH4Cl | D.CCl4和KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com