
| A. | 1s22s1 | B. | 1s22s12p1 | C. | 1s22s22p63s2 | D. | 1s22s22p63s1 |
分析 处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、泡利不相容原理和洪特规则,以此解答该题.
解答 解:A.基态原子的电子排布式为1s22s1,符合基态原子电子排布规律,故A不选;
B.基态原子的电子排布式应为1s22s2,发生电子跃迁为1s22s12p1,所以不是基态原子电子排布式,故B选;
C.基态原子的电子排布式为1s22s22p63s2,符合基态原子电子排布规律,故C不选;
D.基态原子的电子排布式为1s22s22p63s1,符合基态原子电子排布规律,故D不选;
故选B.
点评 本题考查核外电子排布,题目难度不大,明确基态电子排布规律与能量跃迁的关系为解答关键,试题培养了学生的分析能力及灵活应用能力.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)<E(4s)<E(3d) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、SO42-、Cu2+ | B. | Na+、NH4+、H+、CO32- | ||
| C. | K+、Fe2+、H+、NO3- | D. | Ca2+、Ba2+、SO42-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

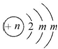
 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物的最简式相同,同分异构体的分子式相同 | |
| B. | 通式相同的是同系物,相对分子质量相同的是同分异构体 | |
| C. | 同系物的通式相同,同分异构体的相对分子质量相同 | |
| D. | 官能团相同的是同系物,含碳量相同的是同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com