
【题目】丙烯(C2H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。
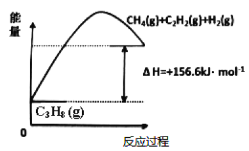
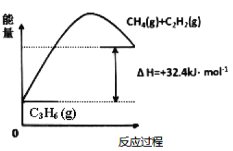
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)C3H6(g)+H2(g) H=____________kJ/mol
①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是________。
②目前在丙烷脱氢制丙烯时常通入适量的O2,让其同时发生下列反应:2C3H8(g) +O2(g)2C3H6(g)+2H2O(g) H=-235kJ/mol,通入O2的目的是_______。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8(g)+C2H4(g)2C3H6(g) H>0
①某温度下,上述反应中,正反应速率为v正=K正c(C4H8)c(C2H4)、逆反应速率为v逆=K逆c2(C3H6),其中K正、K逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是_____________
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使K正和K逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应程度无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___________25%(填“>”、“<”、“=”)。
(3)工业上可用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
Ⅰ. CH2=CHCH3(g)+Cl2(g)CH2ClCHClCH3(g)
II. CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应Ⅰ,容器内气体的压强随时间的变化如表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
【答案】+124.2 升高温度 丙烷直接裂解是吸热反应,通入足量O2可提供裂解所需的能量,并保持热平衡 BCD > 0.09 0.21
【解析】
I.(1)结合图像及盖斯定律进行计算;
①反应为吸热反应,升高温度,反应速率增大和平衡正向移动;
②通入足量O2可与裂解产生的氢气反应,提供裂解所需的能量,并保持热平衡;
(2)①A.催化剂参与了歧化反应,生成了中间产物,即改变反应历程;
B.催化剂导致反应速率增大,但化学平衡常数不变,则使K正和K逆增大相同的倍数;
C.催化剂导致反应速率增大,则降低了烯烃歧化反应的活化能,增大了活化分子百分数;
D.根据公式,速率常数的大小与反应的始态或终态有关,与反应程度无关系;
②Qc与K的关系判断;
II.利用三段式及反应速率的公式进行计算。
(1)根据左图,可得①C3H8(g)C2H2(g)+H2(g)+CH4(g) H=+156.6kJ/mol,右图可得,②C3H6(g) C2H2(g)+CH4(g) H=+32.4kJ/mol,根据盖斯定律,①-②可得C3H8(g)C3H6(g)+H2(g),则H=+124.2kJ/mol;
①该反应为吸热反应,升高温度,可同时提高反应速率和反应物的平衡转化率;
②丙烷直接裂解是吸热反应,通入足量O2可与裂解产生的氢气反应,提供裂解所需的能量,并保持热平衡;
(2)①A.催化剂参与了歧化反应,生成了中间产物,即改变反应历程,说法错误,A错误;
B.催化剂导致反应速率增大,但化学平衡常数不变,则使K正和K逆增大相同的倍数,说法正确,B正确;
C.催化剂导致反应速率增大,且不影响反应的焓变,则降低了烯烃歧化反应的活化能,增大了活化分子百分数,说法正确,C正确;
D.根据公式,速率常数的大小与反应的始态或终态有关,与反应程度无关系,说法正确,D正确;
答案为BCD;
②已知平衡时,n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡时C3H6的体积分数为25%,![]() =25%,则b=amol,K=0.5;再往容器内通入等物质的量的C4H8和C2H4,化学平衡常数不变,则Qc=
=25%,则b=amol,K=0.5;再往容器内通入等物质的量的C4H8和C2H4,化学平衡常数不变,则Qc=![]() (x>0),(1+x)(2+x)>2,Qc<K,则平衡正向移动,再次达到平衡时C3H6的体积分数大于25%;
(x>0),(1+x)(2+x)>2,Qc<K,则平衡正向移动,再次达到平衡时C3H6的体积分数大于25%;
II.①前120min内压强减小即P=80-69.2=10.8kPa,则v(CH2ClCHClCH3)=![]() =0.09kPamin-1。
=0.09kPamin-1。
②
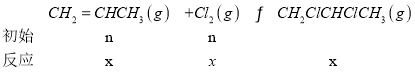
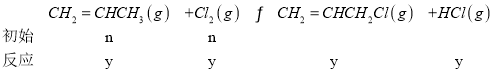
根据表格数据可知,300min达到平衡,则![]() =
=![]() ,x=0.56n;平衡时HCl的体积分数为12.5%,即
,x=0.56n;平衡时HCl的体积分数为12.5%,即![]() =12.5%,则y=0.18n,Kp=
=12.5%,则y=0.18n,Kp=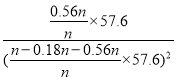 =0.21kPamin-1。
=0.21kPamin-1。


科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动。
【探究一】
(1)甲同学将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________。
【探究二】
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O===2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略):
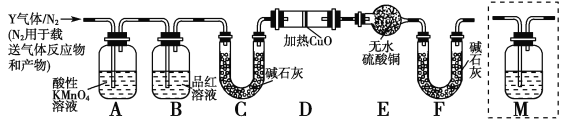
(3)装置B中试剂的作用是________。
(4)认为气体Y中还含有Q的理由是_____________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于________(选填序号)。
a.A之前 b.A—B间 c.B—C间 d.C—D间
(6)如果气体Y中含有H2,预计实验现象应是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是
A.向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+)
B.新制氯水使红色布条褪色(HCl)
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-)
D.向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基酸微量元素螯合物在饲料生产应用、解决过量添加无机盐造成环境污染等方面有重要应用。该类螯合物通常以蛋氨酸、赖氨酸、甘氨酸等为配位体,以铜、铁、锌、锰、铬、钴等元素为中心离子。
(1)甘氨酸中共有_____个σ键,所含元素的电负性由大到小的顺序为______,官能团中C原子的杂化方式为_______。
(2)上述金属元素中,基态原子有五个未成对电子的原子的核外电子排布式为______。
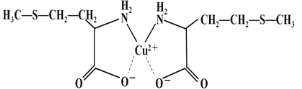
(3)蛋氨酸铜的结构式如下图。该螯合物中含有的化学键类型有_________(填序号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(4)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。某化合物的化学式为Na3CrO8,其阴离子结构可表示为![]() ,则Cr的化合价为______。
,则Cr的化合价为______。![]() 呈四面体构型,结构为
呈四面体构型,结构为![]() ,
,![]() 由两个
由两个![]() 四面体组成,这两个
四面体组成,这两个![]() 四面体通过共用一个顶角氧原子彼此连接,结构为
四面体通过共用一个顶角氧原子彼此连接,结构为![]() 。则由n(n>1)个
。则由n(n>1)个![]() 通过顶角氧原子连结的链式结构的化学式为____。
通过顶角氧原子连结的链式结构的化学式为____。
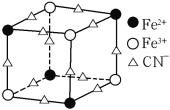
(5)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3 与KSCN溶液混合,可得到配位数为5的配合物的化学式是____;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如下图所示(K+未画出),则一个晶胞中的K+个数为____。
结构如下图所示(K+未画出),则一个晶胞中的K+个数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
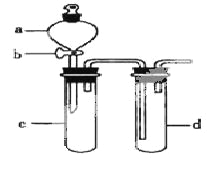
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是__________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________。
再由a向c中加2mL蒸馏水,c中的实验现象是_____________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____,理由是_______。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是_________;该小组同学实验目的是_________,但此实验的不足之处是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中的曲线是表示其他条件一定时,2NO(g)+O2(g)2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正>v逆的点是( )

A.a点
B.b点
C.c点
D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】公认的人体必需金属元素是钠和钾。在动物中,钠主要是以氯化钠形式存在于细胞外液中,依靠氯化钠可以把一定量的水吸到细胞里来,使细胞里维持一定的水分。某试剂瓶上贴有如下标签,对该试剂理解正确的是 ( )
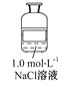
A.该溶液中含有的微粒主要有NaCl、Na+、Cl-、H2O
B.若取50毫升溶液,其中的c(Cl-)=0.05 mol·L-1
C.若取该溶液与100 mL 0.1 mol·L-1AgNO3溶液完全反应,需要取该溶液10 mL
D.该溶液与1.0 mol·L-1Na2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,由浙江大学饶灿教授课题组发现的一种新矿物LiAl5O8,被国际矿物学协会命名为“竺可桢石”,英文名为Chukochenite。回答下列问题:

(1)基态Li+核外电子的电子云轮廓图为___________。
(2)第二电离能:I2(Mg)___________I2(Al)(填“>”“<”或“=”)。
(3)已知:O2-、F-的半径依次为140 pm、136 pm,Li2O、LiF的熔点依次为1840K、1121K。Li2O的熔点高于LiF的主要原因是____________。
(4)LiAlH4是重要供氢剂和还原剂,工业上利用AlC3和LiH在特殊条件下合成LiAlH4。
①氯化铝蒸气中存在Al2Cl6分子且每个原子价层都达到8电子结构,画出Al2Cl6的结构式___________。(要注明配位键和普通共价键),铝的杂化类型是___________。
②AlH![]() 的空间结构是_____________。
的空间结构是_____________。
(5)某锂钴复合氧化物晶胞如图1所示。该化合物的化学式为_______________。Co3+和NH3形成配离子[Co(NH3)6]3+,游离态NH3中键角∠HNH___________(填“大于”“小于”或“等于”)[Co(NH3)6]3+中键角∠HNH。
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属于正交晶系(长方体形)。品胞参数为0.75 nm、1.0 nm、0.56 nm。如图2为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
①据此推断该晶胞中氯原子数目为___________。LiCl·3H2O的摩尔质量为M g·mol-1,晶胞密度为d g·cm-3,则阿伏加德罗常数NA为___________mol-1(列出计算表达式)。
②图2中A、B两原子核间距离为___________nm(只列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是

A. 正硼酸晶体属于分子晶体
B. 正硼酸分子的稳定性与氢键无关
C. 1molH3BO3晶体中含有3mol氢键
D. B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com