解答:
解:(1)平衡状态的判断依据是正逆反应速率相等,各组分的浓度保持不变,
A、反应物A与B加入的反应物的物质的量之比等于其化学计量数之比,所以平衡后A与B的转化率之比等于化学计量数之比为1:2,故A正确;
B、当2v
正(A)=v
逆(B)时,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C、转化率为x,则平衡后有A、B、C物质的量分别为n-nx、2n-nx、2nxmol,平衡后气体总物质的量为3n-nx,恒容容器中,气体物质的量之比等于其压强之比,故C正确;
D、恒容容器中,充入惰性气体(如Ar),平衡不移动,故D错误;
故选ABC;
(2)在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g)
2C(g)△H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x,
A(g)+2B(g)
2C(g)
起始量(mol) n 2n 0
变化量(mol) nx 2nx 2nx
平衡量(mol) n-nx 2n-2nx 2nx
平衡浓度为,c(A)=
mol/L,c(B)=
mol/L,c(C)=
mol/L
平衡常数K=
=
=
,
增大容器体积时,c(B)和c(C)等比例减小,由于A的浓度不变,此时
的值仍然等于K,所以平衡不移动;
故答案为:
;C;
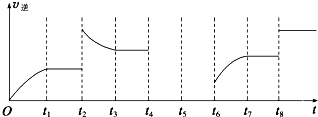
(3)由于纵坐标只表示v
逆,为了便于求解,在解题时可把v
正补上,t
2时平衡逆向移动,采用的条件可以是升温或增大C的浓度;t
8时平衡不移动,采用的条件是使用了催化剂.
①该反应是一个反应前后气体体积减小的且是正反应是放热的化学反应,t
2时逆反应速率增大,且平衡时反应速率大于t
2时反应速率,平衡向逆反应方向移动,改变的条件为增大生成物C浓度或升高温度,t
8时平衡不移动,采用的条件是使用了催化剂.
故答案为:增大生成物C浓度或升高温度;使用催化剂;
②t
2时逆反应速率增大,且平衡时反应速率大于t
2时反应速率,平衡向逆反应方向移动,故答案为:逆反应.

 一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g)??2C(g)△H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x.根据以上条件,回答下列问题:
一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g)??2C(g)△H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x.根据以上条件,回答下列问题:

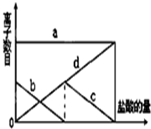 少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
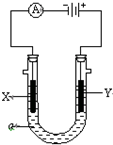 (1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是