
| m |
| M |
| N |
| NA |
| 1.2g |
| 0.01mol |
| 1.806×1023 |
| 6.02×1023mol-1 |
| 0.3mol |
| 4 |


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
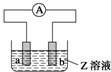 如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,
如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,| a极板 | b极板 | a电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 正极 | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1
(1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2为30mL,O2为15mL |
| B、NH3为30mL,O2为15mL |
| C、CO2为15mL,O2为30mL |
| D、CO2 为30mL,O2为15mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeO固体放入稀硝酸溶液中:FeO+2H+═Fe2++H2O |
| B、过量的铁粉与稀硝酸溶液反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| C、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
| D、向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①② | B、只有①②③ |
| C、只有①②④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3、NaHCO3两种盐的溶液中,离子种类相同 | ||
| B、在CH3COONa溶液中c (CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
C、在0.1mol?L-1的醋酸溶液中加入适量的蒸馏水,溶液的
| ||
| D、常温下,某溶液中由水电离出的c(H+)为10-5 mol/L,则此溶液可能是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KOH溶液与KHSO4溶液反应:OH-+H+═H2O |
| B、稀H2SO4与Ba(OH)2溶液反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
| C、铁与盐酸反应:Fe+2H+═Fe3++H2↑ |
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com