
【题目】下列说法不正确的是
A. 二氧化氮会导致酸雨和光化学烟雾,危害较大
B. 铝的氧化物熔点高,常用于制造耐火材料
C. 人体中极少量的NO会促进血管扩张,可防止血管栓塞
D. Al(OH)3胶体能凝聚水中的悬浮物并使之沉降,因此明矾常用于自来水消毒剂
科目:高中化学 来源: 题型:
【题目】三蝶烯是最初的“分子马达”的关键组件,三碟烯某衍生物X可用于制备吸附材料,其结构如图所示,3个苯环在空间上互为120°夹角。下列有关X的说法错误的是

A. 分子式为C22H14O4
B. 能发生加成、取代反应
C. 苯环上的一氯代物有3种
D. 分子中最多可能有20个原子位于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C. Cl2既做氧化剂又做还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制 100 个水分子含有 1 个钠离子的溶液,90.9 g 水中需要投入钠的质量是
A. 4.6 g B. 2.3 g C. 1.161 5 g D. 1.15 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在生产生活和环境保护中应用广泛。
Ⅰ.碳氧化合物的综合利用
(1)利用CO可有效降低柴油发动机在空气过量条件下的NO 排放。
已知:反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746 kJ·mol-1
N2(g)+2CO2(g) △H=-746 kJ·mol-1
反应Ⅱ:4CO(B)+2NO2(g)![]() N2(g)+4CO2(g) △H=-1200kJ·mol-1
N2(g)+4CO2(g) △H=-1200kJ·mol-1
则反应NO2(g)+CO(g)![]() CO2(g)+NO(g)的△H=__________kJ·mol-1。
CO2(g)+NO(g)的△H=__________kJ·mol-1。
在一定条件下,将NO2与CO以体积比1:2置于恒容密闭容器中发生反应Ⅱ,下列能说明反应达到平衡状态的是______________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.NO2 与CO的体积比保持不变
(2)工业上利用CO 与Cl2在活性炭催化下合成光(COCl2),反应方程式为: CO(g) +Cl2(g) ![]() COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
COCl2(g) △H<0。某研究小组在恒温条件下,向2L恒容容器中加入0.2molCO和0.2molCl2,10min时达到平衡,测得10min 内v(COCl2)=7.5×10-3mol·L-1·min-1,则平衡时n(Cl2)=________ mol,设此时CO的转化率为a1,若其它条件不变,上述反应在恒压条件下进行,平衡时CO的转化率为a2,则a1_______a2 (填“>”“=”或“<”)
(3)利用“组合转化技术”可将CO2 转化成乙烯,反应方程式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
CH2=CH2(g)+4H2O(g)。实验测得温度对CO2 平衡转化率、催化剂催化效率的影响如图a所示。下列说法正确的是________________
a.N点正反应速率一定大于M 点正反应速率
b.250℃时,催化剂的催化效率最大
c.M点平衡常数比N点平衡常数大
d.随着温度升高,乙烯的产率增大
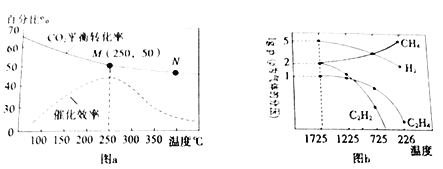
Ⅱ.碳氢化合物的综合利用
利用甲烷的裂解可以制得多种化工原料,甲烷裂解时发生的反应有:2CH4(g)![]() C2H4(g)+2H2(g),2CH4(g)
C2H4(g)+2H2(g),2CH4(g)![]() C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
C2H2(g)+3H2(g) 。实验测得平衡时气体分压(Pa)与温度(℃)之间的关系如图b所示(气体分压=总压×气体的物质的量分数)。
(4)1725 ℃时,向1L恒容密闭容器中充入0.3 molCH4达到平衡,则反应2CH4(g)![]() C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
C2H4(g)+2H2(g)的平衡常数KP=___________(用平衡分压代替平衡浓度),CH4生成C2H2 的平衡转化率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚(CH3OCH3)等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示,则在10 min时,改变的外界条件可能是__________________________。

(2)反应③中ΔH3=_____________。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是_________(填代号)。
a.v正>v逆 b.v正<逆 c.v正=v逆 d.无法判断
(3)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。___________

(4)某合成气的主要成分中的一氧化碳,在一定条件下也可用NaOH溶液与CO反应生成甲酸钠(HCOONa),进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L b mol·L-1NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数Ka=_________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=lgc(S2-)或-lgc(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀(温度升高,NiS、NiCO3Ksp均增大),298K时,溶液中阳离子、阴离子浓度的负对数关系如图所示。下列说法不正确的是

A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线I,在b点加热(忽略蒸发),b点向c点移动
D. M为3.5且对应的阴离子是CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走近课堂,下列做法符合“绿色化学”理念的是

①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠反应的实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与HCl反应生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A. ②③④ B. ①②③
C. ①②④ D. ①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com