
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是___(填字母).
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为___________ .
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示.
NH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示.
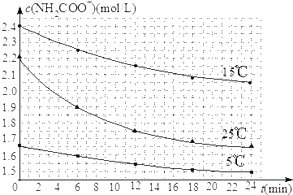
③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为__________ .
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:________________ .
【答案】BC 1.6×10﹣8(mol·L﹣1)3 0.05mol·L﹣1·min﹣1 25℃反应物的起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大
【解析】
(1)①根据化学平衡的标志来判断;
②先根据反应 NH2COONH4(s)2NH3(g)+CO2(g),可知平衡时容器内气体的浓度之比为2:1,由总浓度求出NH3、CO2的平衡浓度,代入平衡常数的表达式计算;
(2)③根据化学反应速率的公式计算;
④由图象数据,用不同初始浓度,不同温度下的平均速率的大小说明.
(1)①A.未指明速率的方向,无法确定正逆反应速率的关系,不能确定反应是否达到平衡状态,故A错误;
B.该反应是气体体积增大的反应,当容器内压强不变时,气体的总量也不再发生变化,已达到平衡,故B正确;
C.容器的体积不变,该反应是气体质量增大的反应,当密闭容器中混合气体的密度不变,已达到平衡,故C正确;
D.因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,为![]() ,不能判定反应是否达到平衡状态,故D错误;
,不能判定反应是否达到平衡状态,故D错误;
故答案为:BC;
②25.0℃时,平衡气体总浓度4.8×10-3mol·L-1,容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为3.2×10-3mol·L-1、1.6×10-3mol·L-1,代入平衡常数表达式:K=(3.2×10-3)2×1.6×10-3=1.6×10-8,故答案为:1.6×10-8;
(2)③25℃时,0~6min氨基甲酸铵水解反应的平均速率为V=![]() =
=![]() =0.05mol·L﹣1·min﹣1,故答案为:0.05mol·L﹣1·min﹣1;
=0.05mol·L﹣1·min﹣1,故答案为:0.05mol·L﹣1·min﹣1;
④25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,说明水解反应的平均速率随温度升高而增大。
故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大。


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】化合物I是一种抗脑缺血药物,合成路线如下:

已知:
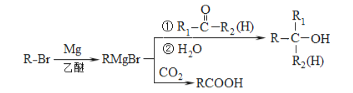
回答下列问题:
(1)按照系统命名法,A的名称是_____;写出A发生加聚反应的化学方程式:__________。
(2)反应H→I的化学方程式为________;反应E→F的反应类型是______。
(3)写出符合下列条件的G的所有同分异构体的结构简式:________
①遇FeCl3溶液发生显色反应 ②核磁共振氢谱有4组峰
(4)α,α-二甲基苄醇(![]() )是合成医药、农药的中间体,以苯和2-氯丙烷为起始原料制备α,α-二甲基苄醇的合成路线如下:
)是合成医药、农药的中间体,以苯和2-氯丙烷为起始原料制备α,α-二甲基苄醇的合成路线如下:

该合成路线中X的结构简式为____,Y的结构简式为________;试剂与条件2为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.6 mol A、0.2 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[其中t0-t1阶段c(B)未画出]。t2时刻后改变条件反应体系中反应速率随时间变化的情况如乙图所示,且四个阶段都各改变一种条件并且改变的条件均不相同。下列说法正确的是( )
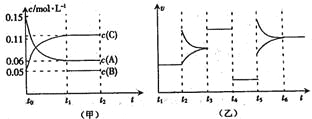
A.反应的方程式为3A(g)+B(g) ![]() 2C(g)
2C(g)
B.t3~t4,t4~t5,t5~t6各阶段可能改变的条件依次为:加催化剂,降低反应温度,增大压强
C.B的起始物质的量为0.08 mol
D.若t1=10 s,A在t0~t1时间段的反应速率为0.00225 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是

A. 该混合气体中一定含有乙烯
B. 该混合气体一定含有甲烷和乙炔
C. 在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用舍勒发现氯气的方法制取氯气并探究其性质。

请回答:
(1)写出装置①中制取氯气化学反应方程式__________。在反应中,是利用了MnO2的_________ (填“氧化性”或“还原性”)。
(2)装置②中的现象是__________。
(3)③中溶液由无色变为橙黄色,发生反应的离子方程式是_________。
(4)用离子方程式解释④中NaOH溶液的作用____________。
(5)取一支试管,加入2 mL ③中橙黄色溶液,再滴入几滴KI-淀粉溶液,观察到溶液变为蓝色。通过以上实验,能否得出结论:Br2的氧化性强于I2 _________(能或否)。理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是亚硝酸根离子与钠离子组成的工业盐,具有咸味,其水溶液呈碱性.亚硝酸钠有毒,含有工业盐的食品对人体危害很大,有致癌性.加热到320℃以上则分解,生成氧气,氮气和氧化钠,能与AgNO3溶液反应生成难溶于水、易溶于酸的AgNO2.
(1)人体正常的血红蛋白含有Fe2+.若误食NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是___________________________(填序号).
A.亚硝酸盐被还原 B.维生素C是氧化剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是氧化剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是_________________(填序号).
A.测定这两种溶液的pH B.用筷子蘸取固体品尝味道
C.加强热收集气体检验 D.用HNO3酸化的AgNO3鉴别
(3)亚硝酸钠受热分解的化学反应方程式为:4NaNO2![]() 2N2↑+3O2↑+2Na2O
2N2↑+3O2↑+2Na2O
①从氧化还原反应角度分析,该反应说明NaNO2具有_____________________.(填氧化性、还原性或者既有氧化性又有还原性)
②该反应中的还原产物为______________________(写名称)
③若反应中转移3mol电子,得到Na2O的质量为________________g.
(4)己知Cl2具有强氧化性,能将溶液中的NO2﹣氧化为NO3﹣同时生成盐酸,请写出NaNO2溶液中通入Cl2的离子反应方程式____________________________________________________________________________.
(5)某工厂废液中,含2%~5%的NaNO2,直接排放会造成污染,NH2Cl能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为______________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO2![]() Fe+3CO2
Fe+3CO2
D.2KMnO4![]() K2MnO4MnO2+O2↑
K2MnO4MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用酚酞作指示剂,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。
(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)

(1)图__(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线,判断的理由是__。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:__。
(3)点①和点② 所示溶液中:c(CH3COO-)-c(CN-)__c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)点②③④所示的溶液中水的电离程度由大到小的顺序是:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com