
A是一种无色透明的晶体,进行如下实验。
①取少量A晶体做焰色反应实验,透过蓝色钴玻璃观察,火焰呈紫色。
②取少量A晶体溶于水可以得到无色的溶液,该溶液使石蕊变红。
③取少量A的溶液加过量氨水,有白色沉淀B生成。
④过滤除去③中的B后,在滤液中滴加氯化钡溶液,有白色沉淀C生成,C不溶于稀硝酸。
⑤取少量B滴加氢氧化钠溶液,得无色溶液D。
⑥取少量B滴加盐酸,得无色溶液E。
⑦将47.4 g A晶体在120℃下加热脱水,剩余物的质量为25.8 g。
根据上述实验和结果确定A、B、C、D、E,写出它们的化学式。
A________;B________;C________;D________;E________。
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
已知X是短周期中最活泼的金属,且与R同周期。下列叙述不正确的是 ( )
A.离子半径大小:R3+<X+< M2-
B.Y与M组成的化合物是光化学烟雾的原因之一
C.将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生
D.M氢化物的熔沸点高于Z氢化物的熔沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )。
A.钠和冷水反应:Na+2H2O==Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH-==AlO2-+H2↑
C.金属铝溶于盐酸中:2Al+6H+==2A13++3H2↑
D.铁跟稀硫酸反应:2Fe+6H+==2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类的正确组合是( )
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | HNO3 | NaHCO3 | SO2 |
| B | 烧碱 | H2SO4 | NaCl | CO |
| C | 苛性钠 | CH3COOH | 石灰石 | 水 |
| D | 熟石灰 | H2CO3 | 纯碱 | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的离子,能在溶液中大量共存的是( )
A.K+、Cu2+、NO 、SO
、SO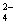 、 B.Na+、Ba2+、CO
、 B.Na+、Ba2+、CO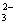 、NO
、NO
C.Na+、H+、Cl-、CO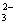 D.Mg2+、H+、C1-、OH-
D.Mg2+、H+、C1-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 m~ 10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
2011年3月,日本发生9级地震,地震引发海啸及伤亡。灾区重建面临多种困难,其中饮水安全是重要问题之一。高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
(1)高铁酸钾中铁元素的化合价为_______价,推测它具有的化学性质是____ __。
(2)在次氯酸钠(NaClO,84消毒液的主要成分)溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。发生的离子反应为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,氧化剂是________。将KOH加入到反应后的溶液搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为2KOH+Na2FeO4====K2FeO4+2NaOH。根据复分解反应原理,高铁酸钠的溶解度________高铁酸钾的溶解度(填“大于”、“小于”或“等于”)。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬)。有关离子方程式为FeO42-+CrO2-+2H2O====CrO42-+Fe(OH)3↓+OH-,2CrO42-+2H+====Cr2O72-+H2O,Cr2O72-+6Fe2++14H+====2Cr3++6Fe3++7H2O
现称取5.00 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液30.00 mL。计算上述实验制得的样品中,高铁酸钾的质量分数为__________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com