
| A. | 锌锰干电池电极总反应为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+H2O,则正极反应为:2MnO2+2H++2e-=Mn2O3+H2O | |
| B. | 将1mol过氧化钠投入含有1molAlCl3的溶液中:6Na2O2+6H2O+4Al3+=4Al(OH)3↓+3O2↑+12Na+ | |
| C. | NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20 H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
分析 A.负极Zn失去电子,正极上Mn得到电子;
B.1mol过氧化钠与水反应生成2molNaOH,与1molAlCl3反应时碱不足;
C.中性时反应生成硫酸钡、硫酸钠和水;
D.Fe的物质的量为$\frac{16.8g}{56g/mol}$=0.3mol,HNO3的物质的量为为0.1L×4mol/L=0.4mol,二者的物质的量比为3:4,Fe过量.
解答 解:A.正极反应为2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O,故A错误;
B.将1mol过氧化钠投入含有1molAlCl3的溶液中的离子反应为6Na2O2+6H2O+4Al3+=4Al(OH)3↓+3O2↑+12Na+,故B正确;
C.NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C错误;
D.将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)的离子反应为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故D错误;
故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇(C2H6O)和乙酸(C2H4O2) | B. | 乙醛(C2H4O)和甲醇(CH4O) | ||
| C. | 丙醛(C3H6O)和甘油(C3H8O3) | D. | 丙酮(C3H6O)和丙二醇(C3H8O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
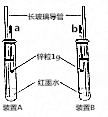 某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象.
某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
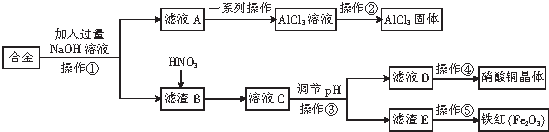
| A. | 滤液A中的溶质主要是NaAlO2和NaOH | |
| B. | 调pH时,可以加入CuO或Cu2(OH)2CO3 | |
| C. | 操作②是在蒸发皿中直接蒸干水分 | |
| D. | 该合金中含有的金属主要为铁、铜、铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
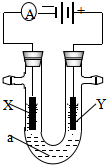 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com