
分析 (1)根据物质中的元素的化合价处于低价时具有还原性,再根据电子守恒及质量守恒定律来配平化学反应方程式;
(2)该反应生成的气体为NO,然后利用化合价变化分析转移的电子数,由化合价变化的氮原子守恒来分析被还原的硝酸的物质的量,再利用反应来计算Cu2O质量;
(3)根据浓硝酸被还原的产物及氧化还原反应来分析原因.
解答 解:(1)KMnO4、Na2CO3、Fe2(SO4)3中Mn、C、Fe元素都处在最高价,则具有氧化性,只有Cu2O中Cu处在较低价,则具有还原性,在NO3-→NO中发生的氧化剂被还原的反应,则该氧化还原反应为Cu2O+HNO3→NO↑+Cu(NO3)2+H2O,Cu元素由+1价升高到+2价,N元素由+5价降低到+2价,由电子守恒及质量守恒定律,配平的化学反应为
3Cu2O+14HNO3═2NO↑+6Cu(NO3)2+7H2O,其中氧化剂与还原剂的物质的量之比为2:3,故答案为:3Cu2O;6Cu(NO3)2;
(2)由反应可知,NO为0.3mol,由2NO~6e-则,0.3molNO生成时转移的电子数为$\frac{0.3×6}{2}$=0.9mol,故答案为:0.9mol;
(3)Cu2O+6HNO3(浓)═2Cu(NO3)2+2NO2↑+3H2O …①,
14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O …②,
将②式子系数除以3得到$\frac{14}{3}$HNO3+Cu2O═2Cu(NO3)2+$\frac{2}{3}$NO↑+$\frac{7}{3}$H2O,
可知用稀硝酸氧化1molCu2O需要$\frac{2}{3}$mol硝酸作氧化剂,用浓硝酸需要2mol硝酸作氧化剂,质量当然增加,
故答案为:使用浓硝酸,产物中有NO2生成.
点评 本题考查氧化还原反应的配平、转移的电子数及利用反应进行的简单计算,明确元素的化合价变化是解答本题的关键.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁离子和铜离子分离开来 | |
| B. | 铁离子和铜离子均转化为难溶的氢氧化物 | |
| C. | 流动相和固定相分离 | |
| D. | 被分离的组分呈现不同的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中,稀释前溶质质量与稀释后溶质质量 | |
| B. | 溶液中,阳离子电荷总数与阴离子电荷总数 | |
| C. | 化学反应中,反应物总能量与生成物总能量 | |
| D. | 化学反应中,参加反应物总质量与生成物总质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
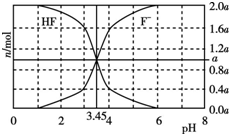 25℃时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1HF溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1HF溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | pH=3时,溶液中:c(Na+)<c(F-) | |
| B. | 当c(F-)>c(HF)时,一定有c(OH-)>c(H+) | |
| C. | pH=3.45时,NaOH溶液与HF恰好完全反应 | |
| D. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2a mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+H2SO4═ZnSO4+H2↑ | |
| B. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | H2S+CuSO4═CuS↓+H2SO4 | |
| D. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
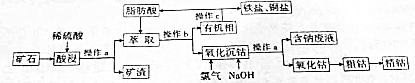
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
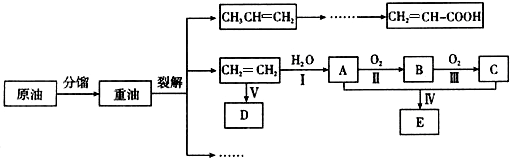
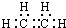 .
.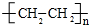 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com