
【题目】【化学—选修3:物质结构与性质】人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:
(1)Ti元素原子序数为22,它在元素周期表中的位置是第 周期第 族;其基态原子的电子排布式为 。
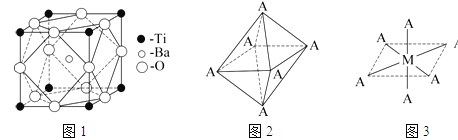
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图1所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 。
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点﹣23.2℃,沸点136.2℃,所以TiCl4应是
化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图2所示,我们通常可以用图3所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请将其结构画出_________________。
【答案】(1)四 IVB 1s22s22p63s23p63d24s2或[Ar]3d24s2
(2)BaTiO36 12
(3)共价 分子 HC1
(4)2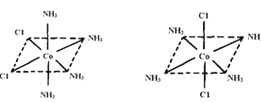
【解析】试题分析:
(1)根据元素周期表可知Ti元素位于元素周期表的第四周期第ⅣB族,Ti元素是22号元素,根据核外电子排布规律可知,它的基态原子的电子层排布式为:1s22s22p63s23p63d24s2或[Ar]3d24s2;
(2)在每个晶胞中均有一个Ba原子,四个Ti原子被四个晶胞共用,每个晶胞中只有一个Ti,12个O原子均被四个晶胞共用,每个晶胞中含有3个O原子,故化学式为BaTiO3,Ti4+的氧配位数为![]() =6,Ba2+的氧配位数为12:
=6,Ba2+的氧配位数为12:
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,熔沸点较低,晶体由分子形成,属于分子晶体,分子由共价键形成,TiCl4在潮湿空气中易挥发,水解而冒白烟,有HCl生成:
(4)Co3+位于正八面体的中心,NH3和Cl-位于正八面体顶点,当两个Cl-相邻时为一种结构,两个Cl-不相邻时为另一种结构,共有两种结构,即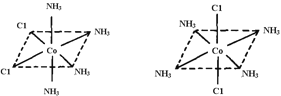 。
。


科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法中,表述正确的是( )
A.加入催化剂加快了反应速率,改变了反应吸收或放出的热量
B.对于某可逆反应,反应进行的净速率是正、逆反应速率之差
C.正反应速率越大,反应物的转化率越大
D.压强越大,活化分子百分数越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质应用的说法错误的是( )
A.玻璃容器可长期盛放各种酸
B.纯碱可用于清洗油污
C.浓氨水可检验氯气管道漏气
D.Na2S可除去污水中的Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. (CH3)3CCH2(CH3)C=CH2的名称为:2,2,4-三甲基-4-戊烯
B. 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种(不考虑顺反异构)
C. 1mol有机物 与NaOH溶液反应,最多消耗5molNaOH
与NaOH溶液反应,最多消耗5molNaOH
D. 1molβ-紫罗兰酮(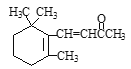 )与1molHBr发生加成反应可得到3种不同产物
)与1molHBr发生加成反应可得到3种不同产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯(MMA)是聚甲基丙烯酸甲酯(有机玻璃)的单体,也用于制造其他树脂、塑料、涂料、粘合剂和润滑剂等.MMA的合成路线如图所示(反应条件和试剂略).
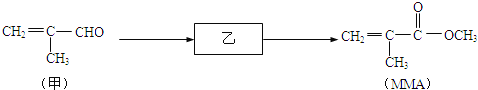
请回答:
(1)甲分子中所含官能团的名称是 .
(2)MMA的分子式是 .
(3)乙的结构简式是 .
(4)MMA在一定条件下生成聚甲基丙烯酸甲酯的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于_______________(选填编号)。
a.主族元素 b.副族元素 c.Ⅷ族元素 d.过渡元素
(2)铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;与Ni等添加到Fe中可制成不锈钢。比较硬度:纯铁_________不锈钢;熔点:纯铁__________不锈钢(填“>”“<”或“=”)。
(3)Cr(OH)3与Al(OH)3的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是___________________。
(4)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
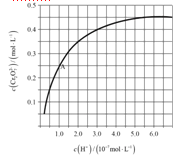
①用离子方程式表示Na2CrO4溶液中的转化反应____________________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH__________0(填“>”“<”或“=”)。
(5)+6价铬的化合物毒性较大,但其化合物用途广泛。如:“酒精检测仪”可检查司机是否酒驾,其反应原理为:m C2H5OH+ n X + p H2SO4═ g Cr2(SO4)3 + w CO2↑+ 9H2O,其中X的化学式最有可能为__________。常用NaHSO3将酸性废液中的Cr2O72还原成Cr3+,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备与工业生产相符的是
①NH3 ![]() NO
NO ![]() HNO3
HNO3
②浓HCl ![]() Cl2
Cl2 ![]() 漂白粉
漂白粉
③MgCl2(aq) ![]() 无水MgCl2
无水MgCl2 ![]() Mg
Mg
④饱和NaCl(aq) ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
⑤铝土矿![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3 ![]() Al
Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.Al2O3用作耐火材料、Al(OH)3用作阻燃剂
B.碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金
C.自然界中不存在游离态的硅,硅主要以二氧化硅和硅酸盐的形式存在 [
D.通过化学变化可以实现12C与14C间的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 0.4mol/L AgNO3 溶液,0.3mol/L MgCl2 溶液和 0.2mol/L 的 AlCl3 溶液按 3:2:1 的体积相混合静置后, 上层清夜中 Cl-的浓度为(混合后溶液体积变化不计)
A. 0.2mol/L B. 0.1mol/L C. 0.6mol/L D. 0.3mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com