
| E |
| E |
| X |
| A、若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
| B、若D是一种强碱,则A、B、C均可与X反应生成D |
| C、若D为NaCl,且A可与C反应生成B,则E可能是CO2 |
| D、若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 |


科目:高中化学 来源: 题型:
| A、40mL 1.5 mol?L-1的 X 溶液 |
| B、20mL 2 mol?L-1的 X 溶液 |
| C、10mL 4 mol?L-1的 X 溶液 |
| D、l0mL 2 mol?L-1的 X 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从碘水中萃取碘,可选用酒精作为萃取剂 |
| B、萃取时所选溶剂应与原溶剂互不相溶,且与溶质不反应 |
| C、萃取后,静置分层,下层液体流出后,打开活塞,用另一只烧杯盛接剩余液体 |
| D、用四氯化碳萃取碘,静置后,上层接近无色,下层为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) |
| B、c(Na+)>c(CO32->c(HCO3-)>c(OH-) |
| C、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-) |
| D、c(HCO3-)+c(CO32-)=0.1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
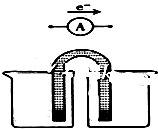 用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 180℃ |
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、单位时间内消耗NO和N2的物质的量比为1:2时,反应没有达到平衡 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com