
| A. | ①③④ | B. | ②③④⑤ | C. | ①②③④ | D. | ①②③④⑤ |
分析 ①活性炭具有吸附性;
②过氧化钠具有 强的氧化性,能够氧化有机色素;
③氯水中次氯酸具有强的氧化性,能够氧化有机色素;
④漂白粉中次氯酸根离子具有强的氧化性,能氧化有机色素;
⑤臭氧具有强的氧化性,能氧化有机色素.
解答 解:①活性炭能使品红溶液褪色,是运用了活性炭的吸附性,故①错误;
②过氧化钠能使品红溶液褪色,是运用了过氧化钠的强氧化性,故②正确;
③氯水中的次氯酸具有强氧化性,次氯酸能使品红溶液褪色是利用其强氧化性,故③正确;
④漂白粉功效原理是漂白粉中的次氯酸钙吸收空气中的二氧化碳和水蒸气反应生成次氯酸,次氯酸具有漂白作用,运用了次氯酸的强氧化性,故④正确;
⑤臭氧能使品红溶液褪色,是运用了臭氧的强氧化性,故⑤正确;
故选:B.
点评 本题考查了元素化合物知识,侧重考查物质的用途,性质决定用途,明确相关物质的性质是解题关键,题目难度不大,注意对相关物质用途的积累.


科目:高中化学 来源: 题型:选择题
| A. | 还原产物为CH3COOH | |
| B. | 氧化剂与还原剂的物质的量之比为2:3 | |
| C. | Cr2O72-和Cr3+分别属于反应物和生成物 | |
| D. | 若把该反应设计从成原电池,则负极反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应吸热 | |
| B. | 达到平衡时,容器II中c(CH3OH)小于容器I中c(CH3OH)的两倍 | |
| C. | 达到平衡时,容器II中c(H2)大于容器III中c(H2)的两倍 | |
| D. | 达到平衡时,容器III中的正反应速率比容器I中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 正丁烷的二氯代物有6种 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 乙烯使酸性高锰酸钾溶液褪色与乙烯使酸性重铬酸钾变色原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 芒硝晶体(Na2SO4•10H2O)白天在阳光下曝晒后失水、溶解吸热,夜里重新结晶放热,实现了太阳能转化为化学能继而转化为热能 | |
| B. | 将植物的秸秆、枝叶、杂草和人畜粪便加入沼气发酵池中,在富氧条件下,经过缓慢、复杂、充分的氧化反应最终生成沼气,从而有效利用生物质能 | |
| C. | 生活、生成中大量应用氢能源,首先要解决由水制备氢气的能耗、氢气的储存和运输等问题 | |
| D. | 垃圾焚烧处理厂把大量生活垃圾中的生物质能转化为热能、电能,减轻了垃圾给城市造成的压力,改善了城市的环境,增强了市民的环保意识 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝可用于治疗胃酸过多 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 铝制容器可以贮运浓硝酸 | D. | 过氧化钠可用作潜水艇供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
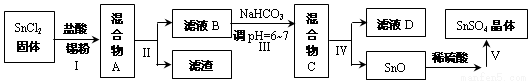
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com