
| A、C的体积分数下降 |
| B、a+b>p |
| C、正反应速率和逆反应速率均减小,平衡向逆反应方向移动 |
| D、正反应速率和逆反应速率均加大,平衡向正反应方向移动 |


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NaSCN+MnO2+2H2SO4═Na2SO4+(SCN)2↑+MnSO4+2H2O |
| B、(CN)2+2KI═2KCN+I2 |
| C、Cl2+2NaOCN═(OCN)2+2NaCl |
| D、2AgCN═2Ag+(CN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
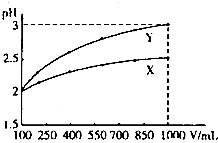
| A、X为弱酸,VX<VY |
| B、Y为强酸,VX>VY |
| C、X为强酸,VX>VY |
| D、Y为弱酸,VX>VY |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,针对所给的10种元素,回答下列问题.
下表是元素周期表的一部分,针对所给的10种元素,回答下列问题.| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 代表氢原子,
代表氢原子, 代表碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)=
代表碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)=查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com