

| c2(HI) |
| c(H2)?c(I2) |
| c2(HI) |
| c(H2)?c(I2) |
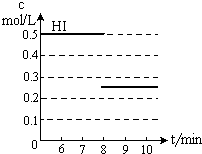 ,故答案为:
,故答案为: .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发结晶时,应将溶液蒸干后才停止加热 |
| B、蒸馏中,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
| D、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气通过盛有水的洗气瓶 |
| B、通过装有过量溴水的洗气瓶 |
| C、混合气与足量溴蒸气混合 |
| D、混合气与过量氢气混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>③>④ |
| B、③=①>②>④ |
| C、③>②>④>① |
| D、②>③=①>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取8gNaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀. |
| D、用100mL量筒量取40mL5mol?L-1NaOH溶液,倒入烧杯中,加水搅拌,将溶液转移至100mL容量瓶中,洗涤烧杯和玻璃棒并转移洗涤液,再加水至刻度,摇匀. |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中还原剂为Fe2+,O2、Fe(OH)3均为氧化产物 |
| B、充分反应后可以看到白色沉淀和气体生成 |
| C、标准状况下,每生成22.4 L O2,则有4 mol Na2O2被还原 |
| D、若有4 mol Na2O2参加反应,则反应中共转移6NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com