
(11分)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42-等离子中的几种离子。
①经实验可知溶液明显呈酸性。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当沉淀增加到一定量后开始产生气体丙,最后沉淀完全溶解。
(1)写出气体丙的电子式___________________。
(2)该溶液中一定不含有:___________________(填离子的化学式)离子,一定含有的离子有___________(填离子的化学式)。
(3)在这些不存在的离子中,有一种离子在酸性环境中与SO2反应,试写出该反应的离子方程式:________________________。
(4)请设计实验方案,检验该试液中是否存在可能含有的离子____________________。
(5)为确定上述溶液中所含的各种离子的物质的量,取100mL上述溶液并向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如图Ⅰ:该溶液中可能存在的离子的物质的量为________mol。

(1) 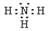 (2)MnO4-、HCO3-、Cl-; NH4+、Al3+、SO42-
(2)MnO4-、HCO3-、Cl-; NH4+、Al3+、SO42-
(3)2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
(4)焰色反应,用洁净的铂丝蘸取试样在无色火焰上灼烧, 透过蓝色钴玻璃,观察火焰颜色,若紫色,则含有K+。 (5)0.1
【解析】
试题分析:无色溶液,则MnO4-一定不存在,根据①溶液呈酸性,则HCO3-一定不存在,根据②可知溶液中一定有SO42-,且SO42-为0.03mol,一定没有Cl-,根据④可以确定溶液中一定有NH4+和Al3+。
据图可知加入Na2O20.15mol,沉淀达到最大值,则Al3+为0.1mol,Na2O2从0.15mol增至0.25mol是与NH4+反应产生氨气,则NH4+为0.2mol,根据溶液中电荷守恒,一定有K+且为0.1mol。
考点:元素推断、离子共存、金属的性质
点评:本题综合性强,主要锻炼学生的推断能力,难度较大,尤其最后的计算。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:江西吉安一中2007-2008学年度上学期高三第一次段考化学试卷 题型:058
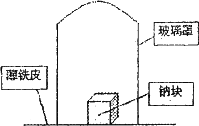
据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:Na3N+4H2O=3NaOH+NH3·H2O.某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了发以下实验:
取11.5 g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1.00L溶液,从中取出25.0 mL溶液,和13.5 mL 1.00 mol·L-1HC1溶液刚好完全反应.求钠在空气中燃烧产物的成分及物质的量.
查看答案和解析>>
科目:高中化学 来源:2013届河南省扶沟县高级中学高三第三次考试化学试卷(带解析) 题型:填空题
(11分)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42-等离子中的几种离子。
①经实验可知溶液明显呈酸性。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当沉淀增加到一定量后开始产生气体丙,最后沉淀完全溶解。
(1)写出气体丙的电子式___________________。
(2)该溶液中一定不含有:___________________(填离子的化学式)离子,一定含有的离子有___________(填离子的化学式)。
(3)在这些不存在的离子中,有一种离子在酸性环境中与SO2反应,试写出该反应的离子方程式:________________________。
(4)请设计实验方案,检验该试液中是否存在可能含有的离子____________________。
(5)为确定上述溶液中所含的各种离子的物质的量,取100mL上述溶液并向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如图Ⅰ:该溶液中可能存在的离子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
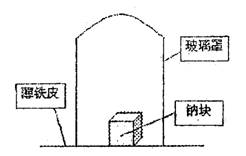
据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:
Na3N+4H2O=3NaOH+NH3?H2O。某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了以下实验:取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1.00L溶液,从中取出25.0mL溶液,和13.5mL 1.00mol?L-1HC1溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:
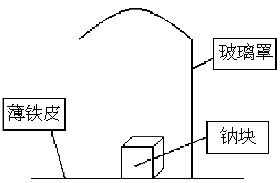
已知钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式为Na3N+4H2O=3NaOH+NH3?H2O。某学校化学研究学习小组为了研究钠在空气中燃烧产物的成分,做了以下实验:
取11.5g钠单质放在一块薄铁皮上,上面扣一玻璃罩(玻璃罩内为干燥且不含酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1000mL溶液,从1000mL溶液中取出的25.00mL溶液和13.50mL1.00mol?L-1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com