
| ³ĮµķĪļ | Fe£ØOH£©3 | Fe£ØOH£©2 | Al£ØOH£©3 |
| æŖŹ¼³Įµķ | 2.3 | 7.5 | 3.4 |
| ³ĮµķĶźČ« | 3.2 | 9.7 | 4.4 |

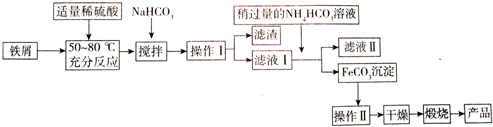
·ÖĪö £Ø1£©ŌŚ·“Ó¦3FeS2+8O2$\frac{\underline{\;øßĪĀ\;}}{\;}$6SO2+Fe304ÖŠ£¬FeS2ÖŠµÄĢśŌŖĖŲŗĶĮņŌŖĖŲ»ÆŗĻ¼Ū¶¼ŌŚÉżøߣ¬ŃõĘųµÄ»Æ»ÆŗĻ¼Ū½µµĶ£¬Ńõ“Ó0¼Ū½µĪŖ-2¼Ū£¬µ±·“Ó¦ÖŠÓŠ8molŃõĘų·“Ó¦Ź±£¬µē×Ó×ŖŅĘŹżÄæĪŖ32mol£¬øł¾Żµē×ӵƏ§ŹŲŗć¼ĘĖć£»
£Ø2£©øßĢśĖįÄĘ¾ßÓŠĒæŃõ»ÆŠŌ£¬æÉÓĆӌɱ¾śĻū¶¾£¬»¹ŌÉś³ÉFe3+£¬Fe3+·¢ÉśĖ®½āÉś³ÉĒāŃõ»ÆĢś½ŗĢåĪüø½Ė®ÖŠµÄŌÓÖŹ£»
£Ø3£©ĢśŠ¼ÓĆ“æ¼īČÜŅŗĻ“Č„ÓĶĪŪ£¬¼ÓĻ”ĮņĖį³ä·Ö·“Ó¦£¬¹żĀĖ£¬ŌŚĀĖŅŗÖŠÉŌ¹żĮæµÄĢ¼ĖįĒāļ§ČÜŅŗ£¬ŃĒĢśĄė×ÓÓėĢ¼ĖįĒāøłĄė×Ó·“Ӧɜ³ÉĢ¼ĖįŃĒĢś³ĮµķŗĶ¶žŃõ»ÆĢ¼”¢Ė®£¬¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµĆµ½Ģ¼ĖįŃĒĢś¹ĢĢ壬Ģ¼ĖįŃĒĢśģŃÉÕµĆµ½Ńõ»ÆĢś£¬
¢Ł²Ł×÷¢ńŹĒ·ÖĄė¹ĢĢåŗĶŅŗĢå»ģŗĻĪļµÄ·½·Ø£»²Ł×÷¢ņµÄĆū³ĘŹĒĻ“µÓ³Įµķ£»
¢ŚNa2CO3ŌŚČÜŅŗÖŠĖ®½āĻŌ¼īŠŌ£¬æÉŅŌŹ¹ÓĶÖ¬Ė®½ā£»
¢ŪŃĒĢśĄė×ÓŌŚČÜŅŗÖŠÄܱ»æÕĘųÖŠµÄŃõĘųŃõ»Æ³ÉĢśĄė×Ó£¬¼ÓČė¹żĮæµÄĢśæÉŅŌ·ĄÖ¹ŃĒĢśĄė×Ó±»Ńõ»Æ£»
¢ÜŅŖÖʱøĮņĖįŃĒĢś£¬Ó¦ÓėĮņĖįĀĮ·ÖĄė£¬øł¾Ż³ĮµķµÄpHŃ”Ōń£»
¢ŻŌŚæÕĘųÖŠģŃÉÕFeCO3»į·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬ŃĒĄė×Ó±»ŃõĘųŃõ»ÆÉś³ÉŃõ»ÆĢś£»
¢ŽøßĆĢĖį¼ŲČÜŅŗ¾ßÓŠĒæŃõ»ÆŠŌ£¬Ź¢·ÅŌŚĖįŹ½µĪ¶Ø¹ÜÖŠ£®
½ā“š ½ā£ŗ£Ø1£©ŌŚ·“Ó¦3FeS2+8O2$\frac{\underline{\;øßĪĀ\;}}{\;}$6SO2+Fe304ÖŠ£¬FeS2ÖŠµÄĢśŌŖĖŲŗĶĮņŌŖĖŲ»ÆŗĻ¼Ū¶¼ŌŚÉżøߣ¬ŃõĘųµÄ»Æ»ÆŗĻ¼Ū½µµĶ£¬Ńõ“Ó0¼Ū½µĪŖ-2¼Ū£¬µ±·“Ó¦ÖŠÓŠ8molŃõĘų·“Ó¦Ź±£¬µē×Ó×ŖŅĘŹżÄæĪŖ32mol£¬øł¾Żµē×ӵƏ§ŹŲŗć£¬µ±3mol FeS2²Ī¼Ó·“Ó¦£¬×ŖŅĘ32molµē×Ó£¬
¹Ź“š°øĪŖ£ŗ32£»
£Ø2£©øßĢśĖįÄĘ¾ßÓŠĒæŃõ»ÆŠŌ£¬æÉÓĆӌɱ¾śĻū¶¾£¬»¹ŌÉś³ÉFe3+£¬Fe3+·¢ÉśĖ®½āÉś³ÉĒāŃõ»ÆĢś½ŗĢåĪüø½Ė®ÖŠµÄŌÓÖŹ£¬æÉÓĆĄ“³żČ„Ė®ÖŠµÄŠüø”Īļ£¬“ļµ½¾»Ė®µÄÄæµÄ£¬
¹Ź“š°øĪŖ£ŗFeO42-ÓŠĒæµÄŃõ»ÆŠŌ£¬ÄÜɱ¾śĻū¶¾£¬±¾Éķ±»»¹ŌĪŖFe3+£¬Fe3+·¢ÉśĖ®½āÉś³ÉĒāŃõ»ÆĢś½ŗĢåĪüø½Ė®ÖŠµÄŌÓÖŹ£¬“ļµ½¾»Ė®µÄÄæµÄ£»
£Ø3£©ĢśŠ¼ÓĆ“æ¼īČÜŅŗĻ“Č„ÓĶĪŪ£¬¼ÓĻ”ĮņĖį³ä·Ö·“Ó¦£¬¹żĀĖ£¬ŌŚĀĖŅŗÖŠÉŌ¹żĮæµÄĢ¼ĖįĒāļ§ČÜŅŗ£¬ŃĒĢśĄė×ÓÓėĢ¼ĖįĒāøłĄė×Ó·“Ӧɜ³ÉĢ¼ĖįŃĒĢś³ĮµķŗĶ¶žŃõ»ÆĢ¼”¢Ė®£¬¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµĆµ½Ģ¼ĖįŃĒĢś¹ĢĢ壬Ģ¼ĖįŃĒĢśģŃÉÕµĆµ½Ńõ»ÆĢś£»
¢Ł²Ł×÷¢ńŹĒ·ÖĄė¹ĢĢåŗĶŅŗĢå»ģŗĻĪļµÄ·½·Ø£¬Ęä²Ł×÷ĪŖ¹żĀĖ£»²Ł×÷¢ņ¹żĀĖŗóµÄ²Ł×÷£¬ĪŖĻ“µÓ³Įµķ£¬
¹Ź“š°øĪŖ£ŗ¹żĀĖ”¢Ļ“µÓ£»
¢ŚNa2CO3ŌŚČÜŅŗÖŠĖ®½āĻŌ¼īŠŌ£¬Äܹ»Ļ“Č„ĢśŠ¼ÉĻµÄÓĶĪŪ£¬
¹Ź“š°øĪŖ£ŗ³żČ„ĢśŠ¼±ķĆęµÄÓĶĪŪ£»
¢ŪŃĒĢśĄė×ÓŌŚČÜŅŗÖŠÄܱ»æÕĘųÖŠµÄŃõĘųŃõ»Æ³ÉĢśĄė×Ó£¬¼ÓČė¹żĮæµÄĢśæÉŅŌ·ĄÖ¹ŃĒĢśĄė×Ó±»Ńõ»Æ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖFe+2Fe3+=3Fe2+£¬
¹Ź“š°øĪŖ£ŗFe+2Fe3+=3Fe2+£»
¢ÜÖʱøĮņĖįŃĒĢś£¬Ó¦ÓėĮņĖįĀĮ·ÖĄė£¬Ó¦µ÷½ŚČÜŅŗpHÉś³ÉAl£ØOH£©3£¬ŅŖ±ÜĆāÉś³ÉÓ¦Fe£ØOH£©2³Įµķ£¬æŲÖĘpHŌŚ4.4”«7.5Ö®¼ä£¬
¹Ź“š°øĪŖ£ŗ4.4”«7.5£»
¢ŻŌŚæÕĘųÖŠģŃÉÕFeCO3»į·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬ŃĒĄė×Ó±»ŃõĘųŃõ»ÆÉś³ÉŃõ»ÆĢś£¬·“Ó¦µÄ·½³ĢŹ½ĪŖ4FeCO3+O2$\frac{\underline{\;øßĪĀ\;}}{\;}$2Fe2O3+4CO2£¬
¹Ź“š°øĪŖ£ŗ4FeCO3+O2$\frac{\underline{\;øßĪĀ\;}}{\;}$2Fe2O3+4CO2£»
¢ŽøĆŹµŃéÖŠ£¬ÓĆøßĆĢĖį¼ŲČÜŅŗµĪ¶ØŃĒĢśĄė×Ó£¬øßĆĢĖį¼ŲČÜŅŗ¾ßÓŠĒæŃõ»ÆŠŌ£¬Ź¢·ÅŌŚĖįŹ½µĪ¶Ø¹ÜÖŠ£¬¹ŹbÕżČ·£¬
¹Ź“š°øĪŖ£ŗb£®
µćĘĄ ±¾Ģāæ¼²éѧɜ¶ŌŹµŃéŌĄķÓėŹµŃé²Ł×÷µÄĄķ½ā”¢ĪļÖŹ·ÖĄėĢį“攢ŌŖĖŲ»ÆŗĻĪļŠŌÖŹ”¢Ńõ»Æ»¹ŌµĪ¶ØÓ¦ÓĆµČ£¬ÄѶČÖŠµČ£¬Ē峞ŹµŃéŌĄķŹĒ½āĢāµÄ¹Ų¼ü£¬ŠčŅŖѧɜ¾ß±øŌśŹµµÄ»ł“”ÖŖŹ¶Óė×ŪŗĻŌĖÓĆÖŖŹ¶·ÖĪöĪŹĢā”¢½ā¾öĪŹĢāµÄÄÜĮ¦£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
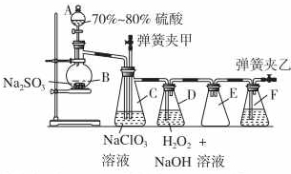 ÓƶžŃõ»ÆĀČ£ØClO2£©æÉÖʱøÓĆĶ¾¹ć·ŗµÄŃĒĀČĖįÄĘ£ØNaClO2£©£¬ŹµŃéŹŅæÉÓĆĻĀĮŠ×°ÖĆ£ØĀŌČ„²æ·Ö¼Š³ÖŅĒĘ÷£©ÖʱøÉŁĮæµÄŃĒĀČĖįÄĘ£®
ÓƶžŃõ»ÆĀČ£ØClO2£©æÉÖʱøÓĆĶ¾¹ć·ŗµÄŃĒĀČĖįÄĘ£ØNaClO2£©£¬ŹµŃéŹŅæÉÓĆĻĀĮŠ×°ÖĆ£ØĀŌČ„²æ·Ö¼Š³ÖŅĒĘ÷£©ÖʱøÉŁĮæµÄŃĒĀČĖįÄĘ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £Ø1£©Ä³ĪĀ¶ČĻĀ£¬ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢Z ČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£®·ÖĪöÓŠ¹ŲŹż¾Ż£¬Š“³öX”¢Y”¢Z·“Ó¦µÄ»Æѧ·½³ĢŹ½X+3Y
£Ø1£©Ä³ĪĀ¶ČĻĀ£¬ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢Z ČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£®·ÖĪöÓŠ¹ŲŹż¾Ż£¬Š“³öX”¢Y”¢Z·“Ó¦µÄ»Æѧ·½³ĢŹ½X+3Y 2Z£®
2Z£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŅŅĖįŅģĪģÖ¬ŹĒ×é³ÉĆŪ·äŠÅĻ¢ĖŲÖŹµÄ³É·ÖÖ®Ņ»£¬¾ßÓŠĻć½¶µÄĻćĪ¶£¬ŹµŃéŹŅÖʱøŅŅĖįŅģĪģõ„µÄ·“ӦװÖĆŹ¾ŅāĶ¼Ķ¼1ŗĶÓŠ¹ŲŹż¾ŻČēĻĀ£ŗ
ŅŅĖįŅģĪģÖ¬ŹĒ×é³ÉĆŪ·äŠÅĻ¢ĖŲÖŹµÄ³É·ÖÖ®Ņ»£¬¾ßÓŠĻć½¶µÄĻćĪ¶£¬ŹµŃéŹŅÖʱøŅŅĖįŅģĪģõ„µÄ·“ӦװÖĆŹ¾ŅāĶ¼Ķ¼1ŗĶÓŠ¹ŲŹż¾ŻČēĻĀ£ŗ +
+ $?_{”÷}^{ÅØH_{2}SO_{4}}$
$?_{”÷}^{ÅØH_{2}SO_{4}}$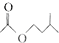 +H2O
+H2O| Ļą¶Ō·Ö×ÓÖŹĮæ | ĆܶČ/£Øg£®cm-3£© | ·Šµć/”ę | Ė®ÖŠČܽāŠŌ | |
| ŅģĪģ“¼ | 88 | 0.8123 | 131 | Ī¢ČÜ |
| ŅŅ“¼ | 60 | 1.0492 | 118 | ČÜ |
| ŅŅ“¼ŅģĪģõ„ | 130 | 0.8670 | 142 | ÄŃČÜ |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CO2 | B£® | CaO | C£® | H2O | D£® | Na2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 ¶ž¼×ĆŃ£ØCH3OCH3£©±»³ĘĪŖ21ŹĄ¼ĶµÄŠĀŠĶČ¼ĮĻ£¬ŌŚĪ“Ą“æÉÄÜĢę“śĘūÓĶ”¢Ņŗ»ÆĘų”¢ĆŗĘųµČ²¢¾ßÓŠÓÅĮ¼µÄ»·±£ŠŌÄÜ£®¹¤ŅµÖʱø¶ž¼×ĆŃŌŚ“߻Ʒ“Ó¦ŹŅÖŠ£ØŃ¹Į¦2.0”«10.0Mpa£¬ĪĀ¶Č230”«280”ę£©½ųŠŠĻĀĮŠ·“Ó¦£ŗ
¶ž¼×ĆŃ£ØCH3OCH3£©±»³ĘĪŖ21ŹĄ¼ĶµÄŠĀŠĶČ¼ĮĻ£¬ŌŚĪ“Ą“æÉÄÜĢę“śĘūÓĶ”¢Ņŗ»ÆĘų”¢ĆŗĘųµČ²¢¾ßÓŠÓÅĮ¼µÄ»·±£ŠŌÄÜ£®¹¤ŅµÖʱø¶ž¼×ĆŃŌŚ“߻Ʒ“Ó¦ŹŅÖŠ£ØŃ¹Į¦2.0”«10.0Mpa£¬ĪĀ¶Č230”«280”ę£©½ųŠŠĻĀĮŠ·“Ó¦£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 HCO3-+OH-£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£»
HCO3-+OH-£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£»²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com