
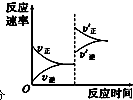
| V2O |
| △ |

| △c |
| △t |
| 0.16mol/L |
| 5min |
| c2(SO3) |
| c2(SO2)c(O2) |
| (0.16)2 |
| (0.04)2×0.02 |
 ;故答案为:
;故答案为: ;
;+ 2 |
+ 2 |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、K+、Ba2+、Cl-、NO3- |
| B、K+、Na+、Br-、S2- |
| C、H+、Fe3+、I-、NO3- |
| D、Na+、Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
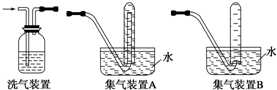
查看答案和解析>>
科目:高中化学 来源: 题型:
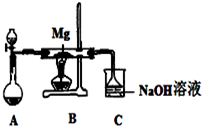 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
| ||
| ||
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后的固体于试管I中 | / |
② | 向试管I中的固体慢慢滴加 试管I口塞上带导管的单孔塞,并将导管通入盛有 | 若试管I中的 则丙同学推测正确.若试管I中的固体未完全溶解,且 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HA的酸性比HB的强,则等浓度的NaA溶液 pH比NaB溶液的小 |
| B、A+和B-的电子层结构相同,则A原子的核电荷数比B原子的小 |
| C、A盐的溶解度在同温下比B盐的大,则A盐溶液的物质的量浓度比B盐溶液的大 |
| D、A原子失去的电子比B原子的多,则A单质的还原性比B单质的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com