
| 物质 组别 | 甲 | 乙 | 丙 |
| A | NH3 | CuO | 稀HNO3 |
| B | Al | 盐酸 | Fe2O3 |
| C | Si | O2 | H2 |
| D | SO2 | NaOH溶液 | 新制氯水 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氨气与CuO在加热条件下反应;
B.Al和Fe2O3在高温下反应;
C.Si和氧气在加热条件下反应,氢气和氧气在点燃条件下反应;
D.二氧化硫可与氢氧化钠溶液反应,具有还原性,与氯水发生氧化还原反应.
解答 解:A.氨气与CuO在加热条件下反应生成氮气和铜、水,常温下不反应,故A错误;
B.Al和Fe2O3的反应为铝热反应,需在高温下反应,故B错误;
C.Si和氧气在加热条件下反应,氢气和氧气在点燃条件下反应,故C错误;
D.二氧化硫为酸性气体,在常温下可与氢氧化钠溶液反应,具有还原性,与氯水发生氧化还原反应,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,把握常见物质的性质及发生的化学反应为解答的关键,明确性质与反应的关系即可解答,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 实验装置与现象 | |||
| 装置 | 甲 | 乙 | 丙 |
 |  |  | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A. | 装置甲中的A处发生了还原反应 | B. | 装置乙中的C金属是负极 | ||
| C. | 装置丙中的D金属是原电池的正极 | D. | 四种金属的活泼性顺序是D>A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融的MgC12冶炼镁 | B. | 用加热HgO的方法制取汞 | ||
| C. | 用Cu与FeSO4溶液反应制取铁 | D. | 用CO还原Fe2O3冶炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏 | B. | 升华 | C. | 浸取 | D. | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
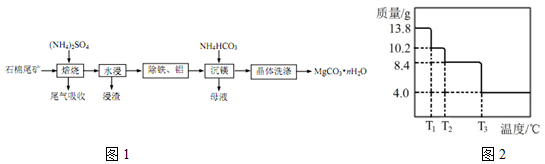
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+Br2→CH2Br-CH2Br | B. | B、CH3CH2OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | ||
| C. |  | D. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | ①NaF | ②NaI | ③MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 离子的核间距 | 23.1nm | 31.8nm | 21.0nm |
| A. | ①>②>③ | B. | ③>②>① | C. | ③>①>② | D. | ②>①>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com