
【题目】下列说法正确的是
A. 已知二元酸H2A在溶液中的电离方程式为:H2A=H++HA- HA-![]() H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)=c(A2-)+c(HA-)+c(H2A)和c(A2-)=c(H+)- c(OH-)
H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)=c(A2-)+c(HA-)+c(H2A)和c(A2-)=c(H+)- c(OH-)
B. 已知:室温时Ka(HA)=10-5.则室温时 0.1mol/LNaA溶液的pH约为10
C. HCN溶液加水稀释的过程中c(H+)/c(CN-)减小
D. 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+)
【答案】D
【解析】A.根据二元酸H2A在溶液中的电离方程式为:H2A=H++HA- HA-![]() H++A2-,可知,第一步电离完全电离,第二步部分电离,则NaHA溶液中只存在电离平衡,根据物料守恒有:c(Na+)=c(A2-)+c(HA-),故A错误;B. NaA溶液中存在水解平衡,Kh=
H++A2-,可知,第一步电离完全电离,第二步部分电离,则NaHA溶液中只存在电离平衡,根据物料守恒有:c(Na+)=c(A2-)+c(HA-),故A错误;B. NaA溶液中存在水解平衡,Kh=![]() =10-9=
=10-9= =
=![]() ,c(OH-)=10-5,c(H+)=10-9,溶液的pH约为9,故B错误;C. HCN溶液加水稀释,促进电离,氢离子的物质的量增加的幅度比CN-大,c(H+)/c(CN-)增大,故C错误;D. 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中含有KAlO2,水解显碱性,离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+),故D正确;故选D。
,c(OH-)=10-5,c(H+)=10-9,溶液的pH约为9,故B错误;C. HCN溶液加水稀释,促进电离,氢离子的物质的量增加的幅度比CN-大,c(H+)/c(CN-)增大,故C错误;D. 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中含有KAlO2,水解显碱性,离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+),故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】25C时,用浓度为0.1000 mol/L的NaOH溶液滴定20. 00 mL 0 .1000 mol·L-1的
CH3COOH.。滴定曲线如图所示。下列分析错误的是

A.C点的溶液:c(CH3COO一)+c(CH.3COOH)>c(Na+)
B.B点的溶液c (CH3COO一)>c(Na+)>c(H+)> c(OH-)
C.A点的纵坐标值为l
D.D点溶液2c(CH3COOH)十c(H+) =c(OH—)—c(CH3COO—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图 1 所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来,图 2、图 3 是用该装置测得的红磷和木炭分别在集气瓶 中燃烧的压强—时间关系图(该装置气密性良好,P0是集气瓶内初始气压,P 和 P′分别是反应结 束后恢复到室温时集气瓶内的气压)。下列说法正确的是

A. 燃烧匙内所装红磷或木炭的多少对实验结果无影响
B. 反应开始时集气瓶中压强瞬间变大是由于燃烧放热造成的
C. P=0.79P0,P′=P0是因为红磷的着火点比木炭低
D. 由图 3 可推出空气中氧气的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙三种金属只有乙能与酸溶液反应产生氢气,而将金属丙投入到金属甲的盐溶液中,能观察到金属丙的表面有金属甲析出。则下列关于金属甲、乙、丙的金属活动性顺序排列正确的是( )
A. 乙>丙>甲B. 甲>丙>乙
C. 乙>甲>丙D. 甲>乙>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的生活、生产离不开化学。下列说法正确的是
A. 市售苏打水的pH约为7
B. 维生素C能使Fe2+转化为Fe3+
C. 光导纤维的导电性能优于铜
D. 硫酸钡常用于X射线造影剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】7N、33As位于同一主族,下列关系不正确的是
A. 原子半径:N < As B. 非金属性:N < As
C. 热稳定性:NH3 > AsH3 D. 酸性:HNO3 > H3AsO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别甲烷和氢气两种无色气体的正确方法是
A. 通入溴水 B. 点燃后罩上干燥的冷烧杯
C. 通入澄清石灰水 D. 点燃后罩上内壁涂有澄清石灰水的烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途。从某含钴工业废料中回收钴的工艺流程如下:
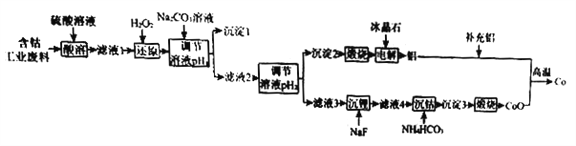
已知:
含钴废料的成分 | |||||
成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
金属离子 | Fe3+ | Co2+ | Al3+ |
开始沉淀的pH | 1.9 | 7.15 | 3.4 |
沉淀完全的pH | 3.2 | 9.15 | 4.7 |
Ⅲ.离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)NaF的电子式为____________。
(2)“沉淀1”的化学式为____________________。“调节溶液pH2”的范围为_________________。
(3)“还原”时发生反应的离子方程式为_______________________。
“沉钴”时发生反应的离子方程式为________________________。
(4)制备Co时,“补充铝”的原因为_________________________。
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=_____________________。
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2=4LiCl+S+SO2,其正极反应式为_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com