
| A、电离平衡常数K(BOH)小于K(HY) |
| B、AY溶液的pH值小于BY的pH |
| C、稀释相同倍数,溶液pH值变化BX小于BY |
| D、将浓度均为1mol?L-1的HX和HY溶液分别稀释10倍后,HX溶液的pH大于HY |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ):
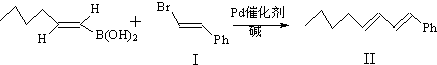
):
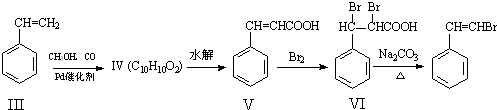
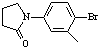 )与化合物(
)与化合物(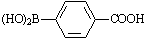 )能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式
)能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.5 mol?L-1 |
| B、4 mol?L-1 |
| C、4.5 mol?L-1 |
| D、5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
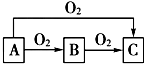 ABC是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去),回答下列问题:
ABC是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3种 | B、4种 | C、5种 | D、6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、②③④ |
| C、①②④ | D、①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 |
| B、重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 |
| C、乙酸与乙醇的混合液可用分液漏斗进行分离 |
| D、可用10mL5mol.L-1的高锰酸钾溶液检验火柴燃烧后生成的气体中是否含有SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com