
分析 甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl-、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,由此可知:甲厂含有K+、Cl-、OH-,乙厂含有Ag+、Fe3+、NO3-,根据两厂中含有的离子组成及性质解答该题.
解答 解:(1)甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,
根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl-、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,
由此可知:甲厂含有K+、Cl-、OH-,乙厂含有Ag+、Fe3+、NO3-,故答案为:K+;Cl-;OH-;
(2)含有的金属离子有K+、Ag+、Fe3+,加入单质Fe,铁可置换出Ag,可以发生反应并回收其中的金属Ag,反应的离子方程式为:Fe+2Ag+=2Ag+Fe2+,
故答案为:Ag;Fe+2Ag+=2Ag+Fe2+;
(3)将甲厂和乙厂的废水按适当的比例混合,可生成AgCl、Fe(OH)3沉淀,反应离子方程式为:Ag++Cl-=AgCl↓、Fe3++3OH-=Fe(OH)3↓;
故答案为:Ag++Cl-=AgCl↓、Fe3++3OH-=Fe(OH)3↓;
(4)生成沉淀的离子有Ag+、Fe3+、Cl-、OH-等,经过滤后的废水主要KNO3,可作化肥使用;
故答案为:KNO3.
点评 本题考查较为综合,涉及离子共存以及离子检验等问题,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意判断甲乙厂废水成分的角度以及离子的性质.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | KOH═K++O2-+H+ | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO4═2H++SO42- | D. | Fe2(SO4)3═Fe23++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “钴酞菁”分子所形成的分散系具有丁达尔效应 | |
| B. | “钴酞菁”分子既能透过滤纸,也能透过半透膜 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 将磁性物质制成胶体粒子作为药物的载体,可在磁场作用下送到病灶处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵变大于0的反应肯定是自发的 | |
| B. | 焓变小于0的反应肯定是自发的 | |
| C. | 对于同一物质在不同状态时的熵值是:气态>液态>固态 | |
| D. | 自发反应的反应速率肯定很快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3>Cl2>I2 | B. | I2>FeCl3>Cl2 | C. | Cl2>FeCl3>I2 | D. | FeCl3>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强酸性溶液中:NH4+、Ca2+、NO3-、HCO3- | |
| B. | 强碱性溶液中:NH4+、Al3+、HCO3-、NO3- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、CO32- | |
| D. | 在无色溶液中:K+、H+、Cl-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
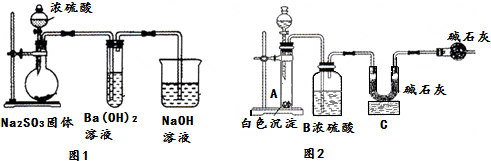
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量稀盐酸,充分振荡. | 若沉淀部分溶解,则含有②. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com