
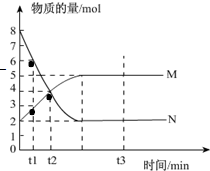
 I、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
I、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:| a |
| b |
| ||
| △t |
| a |
| b |
| ||
| (t2-t1)min |
| 1 |
| V(t2-t1) |
| 1 |
| V(t2-t1) |
| 6mol |
| 8mol |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
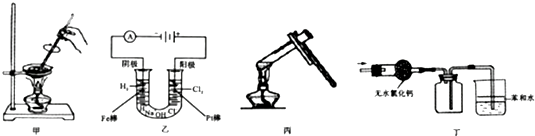
| A、装置甲可用于蒸干NH4Cl饱和溶液制备NH4Cl |
| B、装置乙可用于实验室制备少量氢气、氯气等 |
| C、装置丙可用于实验室检验麦芽糖中是否含有醛基 |
| D、装置丁可用于实验室干燥并收集氨气,同时进行尾气处理,防止污染大气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
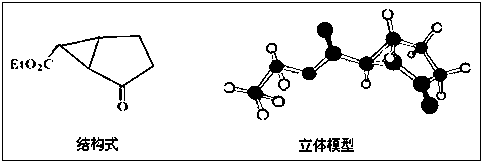
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 成分 | 催化氧化前 | 催化氧化后 |
| O2 | 11% | 未测定 |
| SO2 | 7% | 未测定 |
| N2 | 82% | 84% |
| SO3 | -- | 7% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
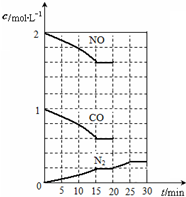 降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5句 | B、6句 | C、7句 | D、8句 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com