
| A. | 氢氧化铝是白色胶状沉淀,能凝聚水中的悬浮物,但不能吸附色素 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大题水冲洗,然后涂上硼酸 | |
| C. | 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 | |
| D. | 酒精灯着火时可用水扑灭 |
分析 A、Al(OH)3胶体吸附悬浮物质而沉降,起净水作用,是常用的净水剂;
B、根据酸、碱的性质分析,酸、碱都具有腐、蚀性;
C、氮气与镁在加热条件下生成氮化镁;
D、从灭火的原理和方法分析,灭火的方法有:(1)与空气(或氧气)隔绝.(2)降温到可燃物的着火点以下.(3)撤走可燃物.
解答 解:A、Al(OH)3胶体具有很大的表面积,吸附悬浮物质而沉降,起净水作用,是常用的净水剂,故A错误;
B、碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液,不能用硫酸或盐酸冲洗,硫酸和盐酸也有腐蚀性,会造成二次伤害,故B正确;
C、氮气与镁在加热条件下生成氮化镁,故C错误;
D、酒精的密度小于水的密度,酒精燃烧时,用自来水灭火时不但不能灭火,而且能扩大燃烧面积,应该用湿抹布盖灭,故D错误;
故选B.
点评 本题考查氢氧化铝的吸附、氮气的化学性质、化学实验安全及事故处理,题目难度不大,注意相关基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
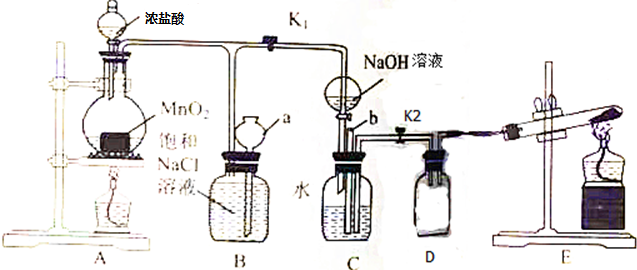
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
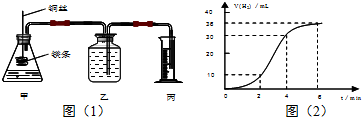
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(NH4+)+c(H+)>c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B在元素周期表的位置第二周期IVA族;
,B在元素周期表的位置第二周期IVA族; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①③② | B. | ①③④② | C. | ①④③② | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
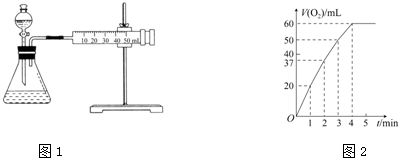
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com