


科目:高中化学 来源: 题型:
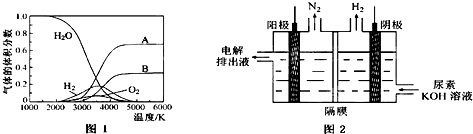
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| T/K | 673 | 773 | … |
| K | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醛和乙酸 |
| B、丁烯和丁烷 |
| C、甲醇和乙醇 |
| D、乙醇和乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
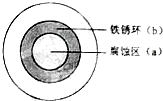 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )| A、液滴中的Cl - 由a区向b区迁移 |
| B、铁腐蚀严重的区域,生锈也严重 |
| C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH- 形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D、液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | ||||
B、0.1 mol?L-1 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO
| ||||
| C、物质的量浓度相等的HF和NaF溶液等体积混合后有:c(Na+)=c(HF)+c(F-) | ||||
| D、0.1 mol?L-1 NaHS溶液中:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com