
已知Ksp(AgCl)=1.8×10-10 mol-2·L-2,Ksp(Ag2CrO4)=1.9×10-12 mol3·L-3,现在向0.001 mol·L-1 K2CrO4和0.01 mol·L-1 KCl混合液中滴加0.01 mol·L-1 AgNO3溶液,通过计算回答:
(1)Cl-、CrO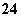 谁先沉淀?
谁先沉淀?
(2)刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是多少?(设混合溶液在反应中体积不变)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体
b L。向反应后的溶液中加入c mol·L-1氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是 ( )
A.c=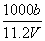
 B.p=m+
B.p=m+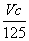 C.n=m+17Vc D.
C.n=m+17Vc D.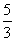 m<p<
m<p<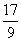 m
m
查看答案和解析>>
科目:高中化学 来源: 题型:
要使工业废水中的重金属Pb2+离子沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+离子与这些离子形成的化合物的溶解度如下:
| 化合物 | PbSO4 | PbCO3 | PbS |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用的沉淀剂最好为( )
A.硫化物 B.硫酸盐 C.碳酸盐 D.以上沉淀剂均可
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去MgCl2的酸性溶液中的Fe3+,可在加热条件下加入一种试剂,过滤后再加入一定量的盐酸,这种试剂是( )
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表中有些元素有“对角线相似”现象,如Li、
Mg;Be、Al;B、Si等两两性质相似。若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结
果得到金属锂和一种无色无味的气体。下列说法正确的是 ( )
A.LiOH易溶于水 B.电解前LiCl在加热时已发生水解
C.无色气体为电解生成的H2 D.Li和水反应要比Na和水剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期元素,
其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的
原子最外层电子数是次外层电子数的三倍,D是所在周期中原子半径最大的主族元素。又知六种元素所形
成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题。
(1)元素D在周期表中的位置________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)________________。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________。
(4) ①若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
②若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________________________________________________________。
③FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质的变化规律,与共价键的键能大小无关的是( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低
④NaF、NaCl、NaBr、NaI的熔点依次降低
A. 仅② B. ①④ C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
碳化硅(SiC)是一种晶体,具有类似金刚石的结构,其中C原子和Si原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中,它们的熔点从高到低的顺序是( )
A.①③② B.②③①
C.③①② D.②①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com