
| 金属离子 | Fe3+ | Al3+ | Fe2+ |
| 开始沉淀的pH | 2.2 | 3.1 | 7.5 |
| 完全沉淀的pH | 3.5 | 5.4 | 9.5 |
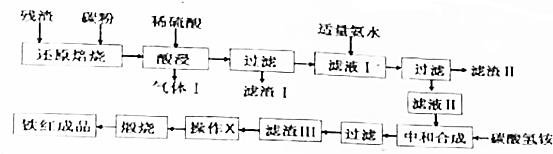
分析 硫铁矿煅烧所得残渣加入碳粉焙烧,还原得到Fe、Si,再用硫酸浸取,Si不反应,Fe与硫酸反应得到气体I为氢气,氧化铝与硫酸反应生成硫酸铝,过滤除去Si,滤液中含有硫酸亚铁、硫酸铝,Fe2+易被氧气氧化,滤液中含有Fe3+,再调节溶液pH使Al3+转化为Al(OH)3沉淀、Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液中加入碳酸氢铵得到FeCO3沉淀,过滤、洗涤、煅烧FeCO3得到氧化铁.
(1)气体Ⅰ的主要成分为氢气,滤渣Ⅱ的主要成分为氢氧化铝、氢氧化铁;
(2)操作X为洗涤;
(3)调节溶液的pH使Al3+、Fe3+转化为沉淀,而Fe2+不能沉淀;
(4)Fe2+易被氧气氧化;
(5)反应离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,根据方程式计算n(Fe2+),进而计算c(Fe2+).
解答 解:硫铁矿煅烧所得残渣加入碳粉焙烧,还原得到Fe、Si,再用硫酸浸取,Si不反应,Fe与硫酸反应得到气体I为氢气,氧化铝与硫酸反应生成硫酸铝,过滤除去Si,滤液中含有硫酸亚铁、硫酸铝,Fe2+易被氧气氧化,滤液中含有Fe3+,再调节溶液pH使Al3+转化为Al(OH)3沉淀、Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液中加入碳酸氢铵得到FeCO3沉淀,过滤、洗涤、煅烧FeCO3得到氧化铁.
(1)气体Ⅰ的主要成分为H2,滤渣Ⅱ的主要成分为Al(OH)3、Fe(OH)3,
故答案为:H2;Al(OH)3、Fe(OH)3;
(2)操作X是洗去FeCO3表面附着的杂质,应为洗涤,
故答案为:洗涤;
(3)调节溶液的pH使Al3+、Fe3+转化为沉淀,而Fe2+不能沉淀,应可知pH再5.4~7.5之间,
故答案为:5.4~7.5;
(4)在空气中“酸浸”时间过长,溶Fe2+被氧气氧化Fe3+,导致溶液中Fe2+含量将下降,反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O;
(5)反应离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,则n(Fe2+)=5n(MnO4-)=5×0.10mol/L×0.012L=0.0060mol,故c(Fe2+)=$\frac{0.006mol}{0.02L}$=0.3mol/L,
故答案为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;0.3.
点评 本题考查物质制备工艺流程,关键是明确工艺流程,熟练掌握元素化合物性质,侧重考查物质的分离提纯、学生分析能力,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液中加入少许食醋可以增强其漂白效果 | |
| B. | 用二氧化硫漂白米粉是违法行为,因为二氧化硫有毒 | |
| C. | 铝制品在生活中非常普遍,这是因为铝不活泼 | |
| D. | 氢氧化铝可用于治疗胃酸过多,但不宜长期服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol Na2CO3和1.6mol NaOH | B. | 1mol Na2CO3与0.6mol NaHCO3 | ||
| C. | 0.8mol Na2CO3和1mol NaOH | D. | 1mol Na2CO3和0.6mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | PCl5的分解率大于a% | |
| B. | PCl5的分解率小于a% | |
| C. | 达到平衡后正逆反应速率比原平衡状态时大 | |
| D. | 达到平衡后正逆反应速率比原平衡状态时小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
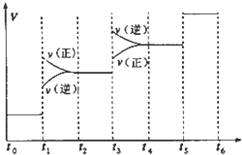 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:| A. | 图中t1时引起平衡移动的条件可能是升高温度 | |
| B. | 表示平衡混合物中NH3的含量最高的一段时间是t5~t6 | |
| C. | 温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为$\frac{16}{{a}_{2}}$ | |
| D. | 在t2~t3时间段,保持容器体积不变,充入一定量的惰性气体,N2的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
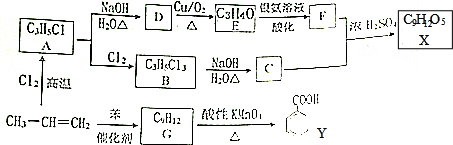
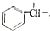 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$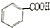
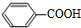 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$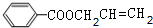 +H2O.
+H2O.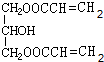 (任写一种即可).对于化合物X,下列说法正确的是AC.
(任写一种即可).对于化合物X,下列说法正确的是AC.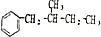 :则Z的同分异构体中,符合
:则Z的同分异构体中,符合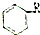 结构且有2个CH3的有3种(不包括Z).
结构且有2个CH3的有3种(不包括Z).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
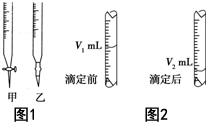 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由SiO2不能与水反应生成H2SiO3,可知SiO2不是H2SiO3的酸酐 | |
| B. | 由SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可知碳的非金属性大于硅 | |
| C. | CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3 | |
| D. | SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com