
【题目】现有下列物质:①NaCO310H2O晶体 ②铜 ③硫酸溶液 ④CO2 ⑤NaHSO4固体 ⑥Ba(OH)2固体 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3固体。
(1)上述物质属于电解质的有(填编号)。
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式。
(3)制取⑦的化学方程式;将⑥的溶液滴加到⑤的溶液中至恰好完全沉淀时的离子方程式。
(4)17.1g⑩溶于水配成250mL溶液,SO42-的物质的量浓度为。
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O当有0.6mol电子转移时,生成的气体标准状况下的体积为L。
【答案】
(1)①⑤⑥⑩
(2)2HNO3+Ba(OH)2=Ba(NO3)2+2H2O
(3)FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl,H++SO42-+Ba2++OH-=BaSO4↓+H2O
Fe(OH)3(胶体)+3HCl,H++SO42-+Ba2++OH-=BaSO4↓+H2O
(4)0.6mol/L
(5)4.48
【解析】(1)电解质包括酸、碱、盐、活泼金属氧化物和水,单质和混合物都不是电解质,因此①NaCO310H2O晶体 ②铜 ③硫酸溶液 ④CO2 ⑤NaHSO4固体 ⑥Ba(OH)2固体 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3固体,10种物质中属于电解质的有:①NaCO310H2O晶体、⑤NaHSO4固体、⑥Ba(OH)2固体、⑩Al2(SO4)3固体,所以答案是:①⑤⑥⑩;(2)H++OH-═H2O,表示可溶性强酸或者强酸的酸式盐与可溶性强碱反应生成可溶性盐和水,可以表示氢氧化钡与硝酸的反应,方程式:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O;所以答案是:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O;(3)实验室制取氢氧化铁胶体的化学方程式为FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl,氢氧化钡与硫酸氢钠按照物质的量之比1:1反应,硫酸根离子恰好沉淀完全,离子方程式:H++SO42-+Ba2++OH-═BaSO4↓+H2O;所以答案是:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl,氢氧化钡与硫酸氢钠按照物质的量之比1:1反应,硫酸根离子恰好沉淀完全,离子方程式:H++SO42-+Ba2++OH-═BaSO4↓+H2O;所以答案是:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl;H++SO42-+Ba2++OH-═BaSO4↓+H2O;(4)硫酸铝是强电解质,能完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,17.1gAl2(SO4)3溶于水配成250mL溶液,SO42-的物质的量为
Fe(OH)3(胶体)+3HCl;H++SO42-+Ba2++OH-═BaSO4↓+H2O;(4)硫酸铝是强电解质,能完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,17.1gAl2(SO4)3溶于水配成250mL溶液,SO42-的物质的量为 ![]() =0.05mol,SO42-的物质的量浓度c=
=0.05mol,SO42-的物质的量浓度c= ![]() =
= ![]() =0.6mol/L,所以答案是:0.6mol/L;(5)在参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,生成NO的物质的量是2mol,转移电子是6mol,若反应中转移了0.6mol电子,产生的气体的物质的量是0.2mol,在标准状况下的体积是0.2mol×22.4L/mol=4.48L,所以答案是:4.48。
=0.6mol/L,所以答案是:0.6mol/L;(5)在参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,生成NO的物质的量是2mol,转移电子是6mol,若反应中转移了0.6mol电子,产生的气体的物质的量是0.2mol,在标准状况下的体积是0.2mol×22.4L/mol=4.48L,所以答案是:4.48。
【考点精析】本题主要考查了物质的量浓度的概念的相关知识点,需要掌握以单位体积里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度;符号CB=nB(mol)/V(L) (nB是溶质B的物质的量,V是溶液体积),单位是mol·Lˉ1才能正确解答此题.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | N2 | NO | NO2 | HNO3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Na | NaOH | Na2CO3 | NaHCO3 |
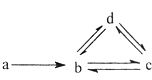
A.①②
B.②③
C.③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表和周期律的说法中,正确的是
A. 元素周期表有7个主族,7个副族,1个0族,1个VIII族,共16纵行
B. F是原子半径最小的非金属元素
C. 短周期中,Cl的非金属性最强
D. 原子半径Na>O,离子半径Na+<O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)属原子晶体,是一种超强透明材料,可以由反应Al2O3+C+N2 ![]() 2AlON+CO合成,下列有关说法正确的是( )
2AlON+CO合成,下列有关说法正确的是( )
A.氮氧化铝中氮的化合价是﹣3
B.反应中氧化产物和还原产物的物质的量之比是1:2
C.反应中每生成5.7gAlON同时生成1.12LCO
D.AlON和CO的化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.01mol氯化铬(CrCl36H2O)在水溶液中用过量AgNO3处理,产生0.02mol AgCl沉淀,此氯化铬最可能为( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2H2O
C.[Cr(H2O)4Cl2]Cl2H2O
D.[Cr(H2O)3Cl3]3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某强氧化剂[RO(OH)2]2+离子2.4×10-3mol被亚硫酸钠还原到较低价态,需12mL0.2mol/L的亚硫酸钠溶液,则反应后R的化合价为( )
A.0B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包铁粉和氧化铜混合均匀的粉末样品4.40g,加入50mL稀硫酸恰好充分反应后,得到只含一种金属阳离子的浅绿色溶液和1.28g固体铜.并放出H2 . 试计算:
(1)固体铜的物质的量为mol,该样品中铁粉和氧化铜的物质的量之比为 .
(2)硫酸的物质的量的浓度molL﹣1 , 产生H2在标准状况下的体积L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓通入到含有等物质的量的KOH,Ba(OH)2和KAlO2的混合溶液中,直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( ) 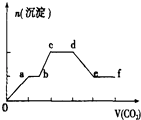
A.d~e段沉淀的减少是由碳酸钡固体的消失所致
B.b~c段反应的离子方程式是:2A1O2﹣+3H2O+CO2=2A1(OH)3↓+CO32﹣
C.0~a段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O
D.a~b段与c~d段所发生的反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol A与2mol B混合于2L的密闭容器中反应:2A(g)+3B(g)2C(g)+zD(g)若2s后,A的转化率为50%,测得v(D)=0.25molL﹣1s﹣1 , 下列推断正确的是( )
A.v(C)=0.2 molL﹣1s﹣1
B.z=3
C.B的转化率为25%
D.C的体积分数为28.6%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com