
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质。已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1 mol·L-1丁溶液的pH=13。下列说法中正确的是
A.元素B在周期表中的位置为第二周期第ⅥA族
B.元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B)
C.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol
D.1 mol甲与足量的乙完全反应共转移了约6.02×1023个电子
科目:高中化学 来源:2014高考名师推荐化学氧、硫及其化合物主要性质(解析版) 题型:选择题
下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿中。
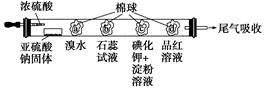
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是
选项 | 现象 | 解释或结论 |
A | a处黄色褪去 | 非金属性:Br>S |
B | b处变为红色 | 二氧化硫与水反应生成酸性物质 |
C | c处变为蓝色 | 二氧化硫具有一定的氧化性 |
D | d处红色先褪去后恢复 | 二氧化硫具有漂白性且漂白性不稳定 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(非金属)(解析版) 题型:选择题
下列叙述错误的是
A.Al2(SO4)3可除去酸性废水中的悬浮颗粒
B.氯气与石灰乳反应能得到含氯漂白剂
C.燃煤时加入适量石灰石,可减少废气中SO2的排放
D.工业上硝酸可用于制化肥、农药、炸药和染料等
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学探究组成、性质的实验方案的设计与评价(解析版) 题型:选择题
下列实验方案不能达到实验目的的是
| 实验目的 | 实验方案 |
A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2 mL 1mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 |
C | 检验蔗糖的水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
D | 测定铝箔中氧化铝的含量 | 取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(已转化为标准状况下) |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学微粒的组成、结构及性质(解析版) 题型:填空题
下表为部分短周期元素化合价及相应原子半径的数据:
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
最高化合价 | +6 | +5 | +4 |
| +5 |
| +7 | +4 |
最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
已知:
①A与D可形成化合物AD2、AD3;
②E与D可形成多种化合物,其中ED、ED2 是常见的化合物,C可用于制光电池。
(1)E在周期表中位置是 ;
(2)C和H的气态氢化物的稳定性强弱关系为 (用分子式表示);
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)工业上可用纯碱溶液处理ED和ED2,该反应如下:
ED+ED2+Na2CO3=2 +CO2
横线上某盐的化学式应为 。
(5)在一密闭容器中发生反应2AD2+D2 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量 (填“增加”“减少”或“不变”)其原因为 。
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量 (填“增加”“减少”或“不变”)其原因为 。
(6)请设计一个实验方案,使铜和稀的H2AD4溶液反应,得到蓝色溶液和氢气。绘出该实验方案装置图。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学弱电解电离(解析版) 题型:选择题
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH—=Al(OH?)3↓
B.加水稀释后,溶液中c(NH4+)·c(OH—)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学弱电解电离(解析版) 题型:选择题
25 ℃时,a mol·L一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
A.a=b B.a>b
C.c(A-)=c(Na+) D.c(A-)<c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学常见仪器的使用(解析版) 题型:选择题
下列①~④四个图是某学习小组设计的相关物质的制备装置,其中正确的是
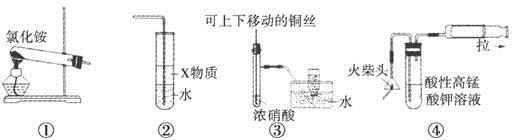
A.用装置①可以制备氨气
B.若装置②中X物质为苯,可用于实验室制备少量氨水,并防止发生倒吸
C.装置③可用于制备并收集少量NO2气体
D.装置④可用火柴头燃烧制备少量SO2,并检验产生的SO2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:实验题
S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组 拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价 降低)。加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2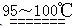 S2Cl2。
S2Cl2。
反应涉及的几种物质的熔沸点如下:
物质 | S | S2Cl2 |
沸点/℃ | 445 | 138 |
熔点/℃ | 113 | -76 |
该小组设计的制备装置如下图(夹持仪器已略去)
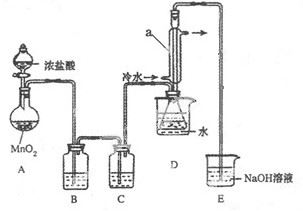
回答下列问题:
(1)连接好实验装置后的第一步实验操作是______。
(2)实验中需要加热的仪器是 (填写字母)
(3)装置B、C中的试剂分别是 。
(4)装置D中仪器a的作用是 。
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是____________。
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因____________。
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生。用离子方程式表示产生该现象的原因____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com