
在铜的冶炼过程中有如下反应发生:5FeS2+1 4CuSO4+12H2O=7Cu2S+5FeSO4+12H2SO4,关于此反应,下列说明正确的是
4CuSO4+12H2O=7Cu2S+5FeSO4+12H2SO4,关于此反应,下列说明正确的是
A.Cu2S既是氧化产物,又是还原产物
B.5 mol FeS2发生反应,有10mol电子转移
C.产物中的SO42-有一部分是氧化产物
D.FeS2只作还原剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年广西桂林十八中高二上期中文化学卷(解析版) 题型:选择题
实验室可用如图所示装置来进行的实验是( )
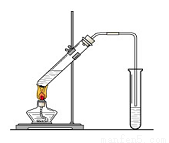
A.制取氧气 B.制取氨气
C.碳酸氢钠受热分解 D.制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练二化学试卷(解析版) 题型:填空题
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
I.汽车内燃机工作时会引起N2和O2的反应:N2+O2 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
(1)在T1、T2温度下,一定量的NO发生分解反应时N2 的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>"或“ <”)。
2NO(g)的△H__________0(填“>"或“ <”)。
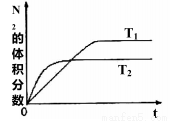
(2)在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)_________。该温度下,若增大压强此反应的平衡常数将____________(填“增大”、“减小”、“不变”或“无法确记”);若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后O2的转化率为__________。
II.甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题
(3)甲醇燃料电池(简称DMFC )由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如右图所示:
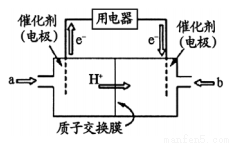
通入a气体的电极是原电池的____________极(填“正”或“负”),其电极反应式为_______________。
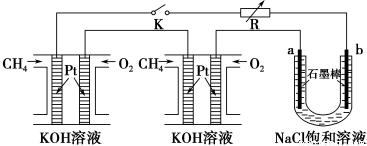
(4)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量为0.224L (标况),且反应完全,则理论上通过电解池的电量为 __________(法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为_________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练二化学试卷(解析版) 题型:选择题
某温度下,体积一定的密闭容器中发生如下可逆反应X(g)+mY(s) 3Z(g) △H,下列说法正确的是( )
3Z(g) △H,下列说法正确的是( )
A.气体的平均密度不变时.说明达到了平衡状态
B.加入少量的X,△H变大
C.加入一定量:的惰性气体,平衡向左移动
D.加入少量的Y正反应速率加快
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:实验题
Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S 2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。

④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________________。其作用是___________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
下列各组中的反应,属于同一反应类型的是
A.溴丙烷和氢氧化钠溶液反应制丙醇;丙烯与水反应制丙醇
B.甲苯硝化制对硝基甲苯;甲苯和高锰酸钾反应制苯甲酸
C.1-氯环己烷制环己烯;丙烯与溴反应制1,2-二溴丙烷
D.苯甲酸乙酯水解制苯甲酸和乙醇;乙酸和乙醇制乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
外围电子构型为3d104s1的元素的原子在周期表中应位于
A. 第五周期ⅠB族 B. 第五周期ⅡB族
C. 第四周期ⅦB族 D. 第四周期ⅠB族
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:填空题
尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
(1)恒温恒容下,在某密闭容器中充入CO(NH2)2和H2O,在120℃、催化剂作用下发生反应:CO(NH2)2 (s) + H2O(g) 2 NH3(g)+CO2(g) △H >0。该反应的化学平衡常数的表达式K= 。
2 NH3(g)+CO2(g) △H >0。该反应的化学平衡常数的表达式K= 。
关于该反应的下列说法正确的是
A.混合气体的平均相对分子质量不再改变,可以作为化学平衡到达的标志
B.在平衡体系中增加水的用量可使该反应的平衡常数增大
C.降低温度使CO(NH2)2的转化率增大
D.达到平衡后,再充入少量H2O,重新达到平衡,H2O的转化率会减小
(2)一定条件下,某密闭容器中充入等物质的量的NH3和CO2,发生反应:CO2(g) +2NH3(g) CO (NH2)2 (s) +H2O(g),混合气体中NH3的体积分数[φ(NH3)]随时间变化关系如图所示。
CO (NH2)2 (s) +H2O(g),混合气体中NH3的体积分数[φ(NH3)]随时间变化关系如图所示。
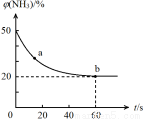
则a点的正反应速率V正(CO2)_________ b点的逆反应速率V逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是___________ 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上11月考试化学卷(解析版) 题型:选择题
某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g) 3Z(g)平衡时, X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、 Z的体积分数不变。下列叙述不正确的是( )
3Z(g)平衡时, X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、 Z的体积分数不变。下列叙述不正确的是( )
A.m=2 B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为 1∶1 D.第二次平衡时,Z的浓度为 0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com