
已知CH4(g)+2O2(g)=CO2(g)+2H2O(l);;△ H=-Q1 kJ/mol
2H2(g)+O2(g)= 2H2O(g);;△ H=-Q2 kJ/mol
2H2(g)+O2(g)= 2H2O(l);;△ H=-Q3 kJ/mol
取体积比4:1的甲烷和H2的混合气112L(标况),完全燃烧后恢复到常温,放出热量为( )
A.4Q1+0.5Q3 B.4Q1+0.5Q2
C.4Q1+Q3 D.4Q1+2Q2
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:阅读理解
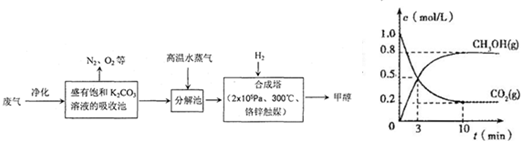
| 一定条件 |
| 一定条件 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
H2(g)+![]() O2(g)
O2(g)![]() H2O(g) ΔH=-
H2O(g) ΔH=-![]() Q2 kJ·mol-1
Q2 kJ·mol-1
H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-
H2O(l) ΔH=-![]() Q3 kJ·mol-1
Q3 kJ·mol-1
常温下取体积比为4∶1的甲烷和氢气的混合气体
C.0.4Q1+0.1Q3 D.0.4Q1+0.2Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
碳及其含碳化合物在人们的生产生活中应用广泛。
(1)天然气是人们日常生活中的清洁能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l); △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2 (g); △H2=-566 kJ·mol-1
则反应2 CH4(g)+3O2(g)=2CO(g)+4H2O(l)的△H=_____________。
(2)甲烷燃料电池的化学方程式为CH4+2O2=CO2+2H2O。某甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以熔融的K2CO3(其中不含O2-和HCO3—)为电解质,以具有催化作用和导电性能的稀土金属为电极。
该燃料电池的负极电极反应式为:CH4-8e-+4CO32—=5CO2+2H2O,则其正极电极反应式为____________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________物质。
(3)以该燃料电池为电源,以铂作电极电解1000g 4.55%的NaOH溶液,一段时间后,溶液中溶质的质量分数变为5.00%,则阳极产生的气体在标准状况下的体积为________L。
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
①实验A中以v(H2)表示的反应速率为___________________。
②通过计算可知,CO的转化率实验A_______________实验B(填“大于”、“等于”或“小于”),该反应的正反应为______________热反应(填“吸”或“放”)。
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是_________________(用含a、b的数学式表示)。
查看答案和解析>>
科目:高中化学 来源:2010届郑州高中毕业班第三次质量预测理综化学部分 题型:填空题
碳及其含碳化合物在人们的生产生活中应用广泛。
(1)天然气是人们日常生活中的清洁能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l); △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2 (g); △H2=-566 kJ·mol-1
则反应2 CH4(g)+3O2(g)=2CO(g)+4H2O(l)的△H=_____________。
(2)甲烷燃料电池的化学方程式为CH4+2O2=CO2+2H2O。某甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以熔融的K2CO3(其中不含O2-和HCO3—)为电解质,以具有催化作用和导电性能的稀土金属为电极。
该燃料电池的负极电极反应式为:CH4-8e-+4CO32—=5CO2+2H2O,则其正极电极反应式为____________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________物质。
(3)以该燃料电池为电源,以铂作电极电解1000g 4.55%的NaOH溶液,一段时间后,溶液中溶质的质量分数变为5.00%,则阳极产生的气体在标准状况下的体积为________L。
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
①实验A中以v(H2)表示的反应速率为___________________。
②通过计算可知,CO的转化率实验A_______________实验B(填“大于”、“等于”或“小于”),该反应的正反应为______________热反应(填“吸”或“放”)。
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是_________________(用含a、b的数学式表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省原名校高三上学期期联考化学试卷(解析版) 题型:填空题
Ⅰ.某溶液中仅含下表离予中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均相等都为0.0lmol。

①若向原溶液中加入KSCN溶液,无明显变化。
②若向原溶液中加入过量的盐酸,有气体生成.溶液中阴离子种类不变。
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题
(1)若先向原溶液中先加入过量的盐酸,再加入KSCN溶液,现象是__________________。该过程中涉及的离子方程式有________________、__________________。
(2)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体为____________________(写化学式)。
(3)向原溶液中加入足量盐酸后,用排水法收集所产生的气体并使气体恰好充满容器,将容器倒置于水槽中,再向容器中通入___________mLO2(气体体积均指标准状况),能使溶液充满该容器。
Ⅱ.amolCu2S和bmol FeS投入到v L c mol/L的稀硝酸中;充分反应,生成NO气体,所得澄清溶液可以看作Cu(NO3)2、Fe(NO3)3和H2SO4的混合溶液,则反应中未被还原的硝酸的物质的量为 ___________mol(用同时含有a、b、v、c的表达式表示)。
Ⅲ.已知CH4(g)+2O2(g) CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g)
CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
2N2(g)+CO2(g)+2H2O(l)的焓变△H2,则还需要查找某反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时△H3=b kJ/mol,则该反应的热化学方程式为______________________________________。
据此计算出△H2=_____________kJ/mol(用含a和b的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com