
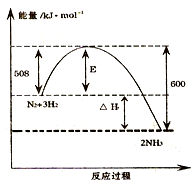
 如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答: 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.分析 (1)由图可知,1mol氮气与3mol氢气反应生成2mol氨气放出的热量为600kJ-508kJ=92kJ,注明物质的聚集状态与反应热书写热化学方程式;
(2)已知:①.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②.2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③.H2O(g)═H2O(l)△H=-c kJ•mol-1
根据盖斯定律,(①-②+③×4)÷2可得:CH3OH(l)+O2(g)═CO(g)+2H2O(l),焓变也进行相应计算.
解答 解:(1)由图可知,1mol氮气与3mol氢气反应生成2mol氨气放出的热量为600kJ-508kJ=92kJ,该反应热化学方程式为:N2(g)+3H2(g)  2NH3(g)△H=-92kJ/mol,
2NH3(g)△H=-92kJ/mol,
故答案为:N2(g)+3H2(g)  2NH3(g)△H=-92kJ/mol;
2NH3(g)△H=-92kJ/mol;
(2)已知:①.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②.2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③.H2O(g)═H2O(l)△H=-c kJ•mol-1
根据盖斯定律,(①-②+③×4)÷2可得:CH3OH(l)+O2(g)═CO(g)+2H2O(l),则△H=$\frac{1}{2}$(b-a-4c) kJ/mol,
故答案为:$\frac{1}{2}$(b-a-4c).
点评 本题考查热化学方程式书写、应用盖斯定律计算反应热,难度不大,注意对盖斯定律的理解与应用.


科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③④ | C. | ③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| W |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力提倡开发化石燃料作为能源 | |
| B. | 研发新型催化剂,提高石油和煤中各组分的燃烧热 | |
| C. | 化石燃料属于可再生能源,不影响可持续发展 | |
| D. | 人类应尽可能开发新能源,取代化石能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸盛放在玻璃试剂瓶中 | |
| B. | 浓硝酸盛在棕色试剂瓶中 | |
| C. | 氢氧化钠溶液盛在带橡皮塞的玻璃瓶中 | |
| D. | 氯水盛在棕色试剂瓶中,并放置在冷暗处 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com