
| 物质名称 | 溶度积(Ksp) | pH | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)2 | 8.0×10-16 | 7.6 | 9.6 |
| Fe(OH)3 | 2.8×10-39 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
| VmL |
| 10mL |
| 116g/mol×2cbV×10-3mol |
| mg |
| 23.2cbV |
| m |
| 23.2cbV |
| m |
| 10-14 |
| 10-12 |
| 5.6×10-12 |
| (10-2)2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl- |
| B、某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- |
| C、某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
| D、某溶液加KOH溶液生成红褐色沉淀,说明原溶液中有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
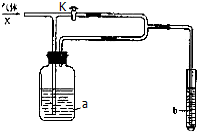 如图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是( )
如图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是( )| a中溶液 | b中溶液 | 气体X | |
| A | 饱和食盐水 | KI-淀粉溶液 | Cl2 |
| B | 酸性KMnO4溶液 | 稀品红溶液 | SO2 |
| C | 饱和NaHS溶液 | CuCl2溶液 | HCl |
| D | 饱和NaHCO3溶液 | 石灰水 | CO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
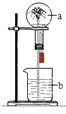 在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )
在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )| A、NO2和水 |
| B、SO2和NaOH溶液 |
| C、NH3和稀盐酸 |
| D、Cl2和饱和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纸层折法分离Fe3+和Cu2+的实验中,点样后的滤纸需晾干后可使用 |
| B、在中和热测定的实验中,可将反应前氢氧化钠溶液的温度作为起始温度 |
| C、将Kcl和NaNO3的混合液加热并浓缩至有晶体析出时,趁热过滤可分离得NaCl晶体 |
| D、(镀锌铁皮锌镀层厚度的测定)实验中,当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 研究硫及其化合物的性质具有重要意义.
研究硫及其化合物的性质具有重要意义.| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、NaHSO3、Na2SO3 | SO3、X、NaHSO4、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
2- 7 |
2- 7 |
2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com