
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是
 A.W点所示的溶液中:
A.W点所示的溶液中:
c(CO32-)=c(HCO3-)>c(OH-)> c(H+)
B.pH=4的溶液中:
c(H2CO3)+ c(HCO3-)+ c(CO32-)=0.1 mol·L-1
C.pH=8的溶液中:
c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D.pH=11的溶液中:
c(Na+)+ c (H+)=c(OH-)+c(Cl-)+ c(CO32-)+c(HCO3-)
【知识点】离子浓度大小的比较
【答案解析】AC 解析:A、W点所示的溶液中:c(CO32-)=c(HCO3-),溶液呈碱性c(OH-)> c(H+),故A正确;B、pH=4,说明反应中有CO2生成,所以根据物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)<0.1 mol•L-1,故B错误;Cc(Na+)最大,从图上可得c(HCO3-) >c(H2CO3)>c(CO32-)故C正确;D、根据电荷守恒得:c(Na+)+ c (H+)=c(OH-)+c(Cl-)+ 2c(CO32-)+c(HCO3-),故D错误;
故答案选AC
【思路点拨】本题考查离子浓度大小的比较,该题是高考中的常见题型,属于综合性试题的考查,对学生的思维能力提出了较高的要求,意在培养学生的逻辑推理能力和创新思维能力.该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒。


科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.向Fe(NO3)3溶液中滴入少量的HI溶液:2Fe3++2I-==2Fe2++I2
B.向苯酚钠溶液中通入少量CO2气体:2C6H5O-+CO2+H2O —→2C6H5OH↓+CO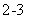
C.Cu(OH)2沉淀溶于氨水得到深蓝色溶液:Cu(OH)2+4NH3== [Cu(NH3)4]2++2OH-
D.澄清石灰水中加入少量NaHCO3溶液:Ca2++2OH-+2HCO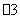 ==CaCO3↓+CO
==CaCO3↓+CO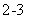 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A、1molNaOH的摩尔质量为40g B、1mol 物质含有的微粒数就是6.02×1023
C、1molN2的体积为22.4L D、0.5molCO2约含有3.01×1023个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32-
B.澄清的溶液中:Na+、K+、MnO4—、AlO2—
C.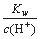 =10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
=10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
D.c(I-)=0.1 mol·L-1的溶液中:Na+、H+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是
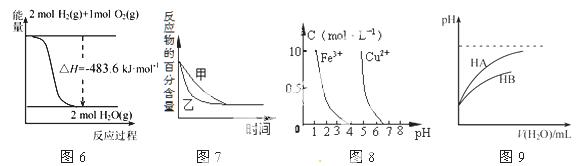 A.图6表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
A.图6表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图7表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图8,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调节pH=4,过滤
D.图9表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g) = MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) = Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) 的△H3= ▲ 。
(2)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。

测得E中Mg元素质量分数为60.0%,则E的化学式为 ▲ 。
“一段脱水”的目的是制备MgCl2·2H2O,温度不高于180 ℃的原因是 ▲ 。
 ②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 ▲ 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 ▲ 。
③该工艺中,可以循环使用的物质有 ▲ 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:
Mg(AlH4)2=MgH2 +2A1+3H2↑
每生成27gAl转移电子的物质的量为 ▲ 。
(4)“镁-次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.蒸发是为了除去溶剂得到晶体,蒸馏是为了得到液体成分
B.金属氧化物一定是碱性氧化物 C.酸性氧化物一定是非金属氧化物
D.物质的量是七个基本物理量之一,是用于描述一定粒子数目的物理量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.信息产业中的光缆的主要成份是单质硅
B.NOx、CO2、PM2.5颗粒都会导致酸雨
C.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
D.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X+Y M+N为吸热反应,对这个反应下列说法中正确的是( )
M+N为吸热反应,对这个反应下列说法中正确的是( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com