
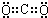
分析 Ⅰ、气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体A为CO2.X中一定不含Si,因为硅酸盐中加入适量盐酸,会产生硅酸沉淀,溶液B中含有氯化镁和氯化铝;
Ⅱ、X中一定不含Na,因为Na的焰色为黄色.
Ⅲ、根据题给信息知调节pH至5~6时生成的白色沉淀C为Al(OH)3.
Ⅳ、加入过量NaOH溶液,沉淀B完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O.
Ⅴ、加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀D为Mg(OH)2.
综上所述:由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:1:3,则CO32-、Al3+、Mg2+的物质的量之比为1:1:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:1:3:7,故X为Mg3Al(OH)7CO3,据此答题.
解答 解:(1)气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2,为共价化合物,电子式为: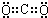 ,
,
故答案为: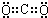 ;
;
(2)X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀,一定不含Na,因为Na的焰色为黄色,磷是15号元素,在周期表中的位置是第三周期VA族,
故答案为:钠、硅;第三周期VA族;
(3)调节pH至5~6时生成的白色沉淀为Al(OH)3,NH3•H20为弱电解质,离子方程式中应写为化学式,
故答案为:Al3++3NH3•H20═Al(OH)3↓+3NH4+;
(4)加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀D为Mg(OH)2,
故答案为:Mg (OH)2;
(5)由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:1:3,则CO32-、Al3+、Mg2+的物质的量之比为1:1:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:1:3:7,故X为Mg3Al(OH)7CO3.
故答案为:Mg3 Al(OH)7 CO3;
(6)I中无色溶液B中含有氯化镁和氯化铝,由于Mg2+,Al3+的水解使溶液显弱酸性,所以溶液B显弱酸性,
故答案为:弱酸性;Mg2+,Al3+的水解使溶液显弱酸性.
点评 本题考查抗酸药成分的探究实验,题目较为综合,本题易错点为第(5)题,根据质量守恒定律解答,难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于盐酸中:Al+2H+═Al3++H2↑ | |
| B. | 碳酸镁溶于硝酸中:2H++CO32-═CO2↑+H2O | |
| C. | 在澄清的石灰水中通入少量的CO2:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 饱和氯化铁溶液滴入沸水中:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的N2和CO含有相同数目的原子 | |
| B. | 1mol臭氧和1.5mol氧气含有相同的氧原子数 | |
| C. | 1mol氧气中含有12.04×1023个氧原子,在常温常压下占有体积22.4L | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
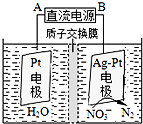 为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.
为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | |
| 反应前质量/g | 64 | 10 | 1 | 25 |
| 反应后质量/g | 0 | 54 | 37 | 9 |
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用分液漏斗前应先检查其是否漏液 | |
| B. | 可以选用苯、汽油、酒精和四氯化碳为萃取剂 | |
| C. | 若用四氯化碳为萃取剂,将两种液体混合,充分振荡,静置,分层后,下层液体呈紫红色 | |
| D. | 分层后,打开分液漏斗活塞,使全部下层液体沿承接液体的烧杯内壁流出,然后上层液体从漏斗上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com