
下列图象在t1时所对应的反应条件改变可能为: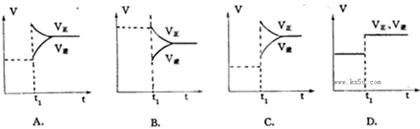
(1)升高温度 ,(2)使用催化剂 ,
(3)增大反应物浓度 ,(4)减少生成物浓度 。
(1) C (2) D (3)A (4)B
解析试题分析:(1)升高温度,瞬间V正、V逆都增大,若正反应为放热反应,V正增大较少、V逆增大较多,
V正<V逆,平衡向逆反应移动,若正反应为吸热反应反应,V正增大较多、V逆增大较少,V正>V逆,平
衡向正反应移动,图象C符合V正增大较多、V逆增大较少,V正>V逆,平衡向正反应移动,正反应为
吸热反应,故答案为:C;(2)使用催化剂,瞬间同等程度增大V正、V逆,V正=V逆,平衡不移动,
图象D符合,注意若反应前后气体的物质的量不变的反应,增大压强图象也符合,故答案为:D;(3)
增大反应物浓度,瞬间V正增大,V逆不变,V正>V逆,平衡向正反应移动,图象A符合,故答案
为:A;(4)减少反应物浓度,瞬间V正不变,V逆降低,V正>V逆,平衡向正反应移动,图象B
符合,故答案为:B。
考点:化学反应速率与化学平衡图象的综合应用;化学平衡的影响因素


科目:高中化学 来源: 题型:填空题
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
 CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的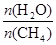 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: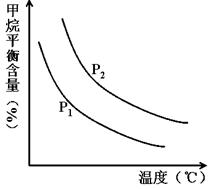
 CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在体积为2 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g) △H=Q,化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g) △H=Q,化学平衡常数K与温度T的关系如下表:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g) △H =" a" kJ/mol
2NH3(g)+CO2(g) △H =" a" kJ/mol
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定条件下,可逆反应A2(g)+B2(g) 2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol·L-1,c(B2)=0.1mol·L-1,c(C)=1.6mol·L-1。若
2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol·L-1,c(B2)=0.1mol·L-1,c(C)=1.6mol·L-1。若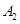 、
、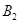 、C的起始浓度分别为a mol·L-1、b mol·L-1、g mol·L-1请确定:
、C的起始浓度分别为a mol·L-1、b mol·L-1、g mol·L-1请确定:
(l)a、g应满足的关系式为_____________。
(2)若反应从正反应方向开始进行,当g=_________,a有最大值为__________。
(3)若反应从逆反应方向开始进行,当b=_________,a有最小值为_________.
(4)b的取值范围为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。 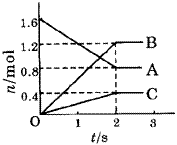
A、B、C三种物质的物质的量随时间变化的关系图
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH 0,△S 0(填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
①在0~2min内,以H2表示的平均反应速率为 mol·L-1·s-1 ,CO的转化率为 。
②列式计算300℃时该反应的平衡常数K= 。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是 。
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题: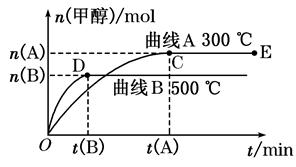
(1)反应达到平衡时,平衡常数表达式K=_________________,升高温度,K值___________(填“增大”、“减小”或“不变”),平衡向 方向移动。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(选填选项字母)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
D.重新平衡时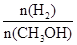 增大 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科学家一直致力于“人工固氨”的新方法研究。目前合成氨技术原理为:N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。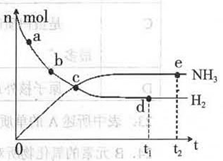
(1)下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0 L恒容得密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下,N2(g)+3H2(g)  2NH3(g)的平衡常数值为:___。
2NH3(g)的平衡常数值为:___。
(3)K值越大,表明反应达到平衡时( )。
A. H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨。其实验装置如图。阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:_____________。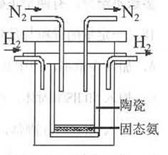
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com