
【题目】将等物质的量的硫酸铝和硫酸铵溶于水形成VL混合溶液,逐渐加入氢氧化钠溶液,直至过量。下列表示氢氧化钠溶液加入的体积(X)与溶液中沉淀的量(Y)关系示意图正确的是
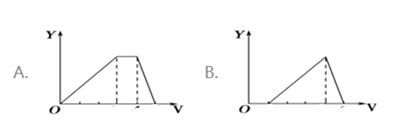
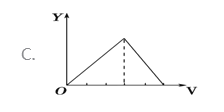
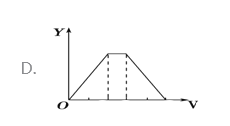
A. A B. B C. C D. D
【答案】A
【解析】假定溶液中含有硫酸铝和硫酸铵的物质的量分别为1mol,开始滴加NaOH发生反应为:Al3++3OH-=Al(OH)3↓,沉淀逐渐增大,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol,沉淀量达最大值;然后发生反应为:NH4++OH-=NH3H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变;最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH。三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,三阶段消耗NaOH溶液的体积比为3:1:1,选项A符合题意,答案选A。


科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
(1)B的反应速率v(B)=__________________X=____________
(2)A在5min末的浓度是________________
(3)此时容器内的压强与开始时之比为:___________。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a. 写出它的电子式______________;
b. 指出它分子内的键型______________。
c. 指出硫元素的化合价为______________。
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。Se2Cl2常用作分析试剂,其结构式为_______。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
c.推测SeO2的化学性质(任写一条即可)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
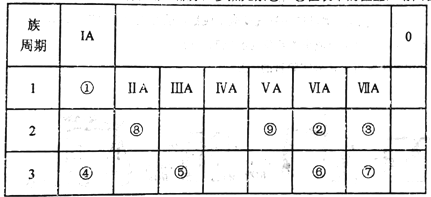
(1)③、④、⑦的原子半径由大到小的顺序是___________(用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比lmo1⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________。
(5)已知W+X=Y+Z (反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
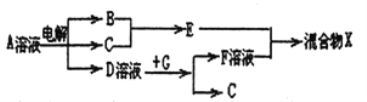
①写出D溶液与G反应的离子方程式_______________。
②写出检验A溶液中溶质的阴离子的方法_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法错误的是( )
硫酸化学纯(CP)
(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g/cm3
质量分数:98%
A. 该硫酸试剂的物质的量浓度为18.4mol·L-1
B. 该硫酸与等体积的水混合所得溶液的质量分数大于49%
C. 配制200mL 4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D. 常温下,将2.7gAl投入足量该硫酸中可得到标准状况下的氢气3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。镁海水电池可为灯塔提供能源,其装置如图所示。下列有关镁海水电池的说法正确的是
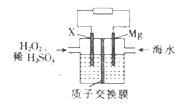
A. Mg电极上发生还原反应
B. 该电池工作一段时间后,左侧溶液质量减轻
C. 正极的电极反应式为H2O2+2e-+2H+=2H2O
D. 若电池工作时转移2 mol电子,则有2 mol H+由质子交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示。下列说法不正确的是( )

A. A为电源的正极
B. 溶液中H+从阳极向阴极迁移
C. Ag-Pt电极的电极反应式为:2NO3-+12H++10e- = N2↑+ 6H2O
D. 电解过程中,每转移2 mol电子,则左侧电极就产生32gO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法不正确的是( )
A. lmolNa2O2与足量水反应,转移的电子数为NA
B. 标准状况下,2.24LCl2与足量铁粉反应转移的电子数为0.2NA
C. 6.0g二氧化硅含有的Si-O键数为0.4NA
D. 2mol硫在空气中完全燃烧,消耗O2的分子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com