
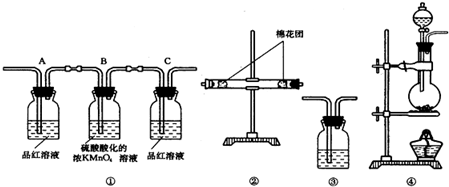
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝金属性强弱 |
| C | 测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH | 比较碳、硫的非金属性强弱 |
| D | Fe、Cu分别与稀盐酸反应 | 比较铁、铜的金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.元素的非金属性越强,其单质与氢气化合越容易;
B.氨气和氯化镁、氯化铝溶液都生成难溶性的氢氧化物沉淀;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,则其相同浓度的最高价氧化物的水化物的钠盐溶液pH越小;
D.元素的金属性越强,其单质与水或酸反应越剧烈.
解答 解:A.元素的非金属性越强,其单质与氢气化合越容易,氯气和氢气在光照条件下能发生反应生成HCl,溴和氢气在加热条件下生成HBr,所以氯气和氢气反应较容易,则非金属性Cl>Br,故A正确;
B.氨气和氯化镁、氯化铝溶液都生成难溶性的氢氧化物沉淀,所以不能比较两种金属的金属性强弱,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,则其相同浓度的最高价氧化物的水化物的钠盐溶液pH越小,根据相同浓度的硫酸钠、碳酸钠溶液的pH判断两种非金属的非金属性强弱,故C正确;
D.元素的金属性越强,其单质与水或酸反应越剧烈,Fe和稀盐酸反应生成氢气,Cu和稀盐酸不反应,所以可以比较两种金属的金属性强弱,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及金属性和非金属性强弱判断方法是解本题关键,侧重考查学生分析判断及实验能力,注意C中如果将硫酸钠换为亚硫酸钠则不能比较其非金属性强弱,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
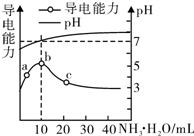
| A. | HR为强酸 | |
| B. | b点溶液呈中性,说明NH4R没有水解 | |
| C. | c点溶液存在c(NH4+)<c( R-) | |
| D. | b~c任意点溶液均有c(H+)×c(OH-)=l.0×l0-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②⑤ | C. | ①②⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应类型是置换反应 | B. | 甲的空间构型是平面正六边形 | ||
| C. | 丙不属于烃类物质 | D. | 分离甲和丙可以采用蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
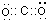 ;一种由B、C组成的化合物与AC2互为等电子体,其分子式为N2O,其结构式为O=N=N.
;一种由B、C组成的化合物与AC2互为等电子体,其分子式为N2O,其结构式为O=N=N. ,E的基态原子的简化电子排布式是[Ar]3d54s1.ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.
,E的基态原子的简化电子排布式是[Ar]3d54s1.ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com