
 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:分析 (1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ•mol-1,
利用盖斯定律将①-②可得目标方程式;
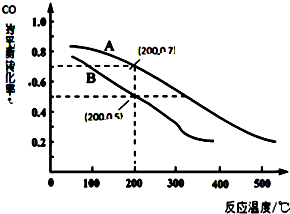
(2)①温度升高,CO的转化率降低,说明升高温度平衡向逆反应方向移动;
②该反应正方向为气体体积减小的反应,根据压强对平衡的影响分析;
③根据温度、压强和浓度对化学平衡的影响分析;
④结合图象,利用三段式法解答该题;
(3)以熔融碳酸盐作电解质,正极上氧气得电子生成碳酸根离子;负极通入煤炭气,则氢气和CO被氧化,则负极生成水和二氧化碳气体,以此解答.
解答 解:(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ•mol-1,
利用盖斯定律将①-②可得C(s)+CO2(g)=2CO(g)△H=+172.5 kJ•mol-1,
故答案为:C(s)+CO2(g)=2CO(g)△H=+172.5 kJ•mol-1;
(2)①由图象可知,随温度的升高其转化率降低,说明升温时平衡逆向移动,正反应放热,
故答案为:放热;
②从方程式可知,反应物有3mol气体,生成物有2mol气体,所以压强增大时平衡气体体积减小的方向移动,即正向移动,在200℃时,转化率高的压强大,
故答案为:A;
③增大反应物的转化率,即要使平衡向正向移动,而影响平衡移动的因素只有三个,温度、压强、浓度,本题只能是降温或加压,
故答案为:降温或加压;
④设加入CO为amol,则有H2 2amol,
CO(g)+2H2(g)?CH3OH(g).
反应前(mol) a 2a 0
反应了(mol) 0.5a a 0.5a
平衡时(mol) 0.5a a 0.5a
可求得:$\frac{0.5a}{0.5a+a+0.5a}$×100%=25%;
故答案为:25%;
(3)以熔融碳酸盐作电解质,正极上氧气得电子生成碳酸根离子,正极电极方程式为:O2+2CO2+4e-=2CO32-;负极上燃料失电子,即CO和氢气失电子发生氧化反应,则负极反应式为CO+CO32--2e-=2CO2和H2+CO32--2e-=H2O+CO2.
故答案为:O2+2CO2+4e-=2CO32-;H2+CO32--2e-=H2O+CO2.
点评 本题考查了热化学方程式和盖斯定律的计算应用、化学平衡移动和化学平衡的有关计算、原电池原理的应用等,注意把握影响平衡的因素分析判断、化学平衡移动原理和原电池电极方程式的书写方法是解题关键,题目难度中等,考查了学生的识图能力以及基础知识灵活运用的能力.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
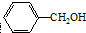 ,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )
,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙烯含有的共用电子对数为2N0 | |
| B. | 常温下,含有1 mo1 NaHSO4的溶液中阳离子数为N0 | |
| C. | 通常状况下,1 mo1 NO和0.5 mo1 O2在密闭容器中混合,生成NO2分子数为N0 | |
| D. | 制取漂白粉时,标准状况下22.4 L Cl2参加反应,转移电子数为N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | c(H+)=c(OH-)=10-7mol/L | ||
| C. | 混合液中Kw=c2(OH-) | D. | c(H+)+c(B+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构 | |
| B. | 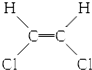 和 和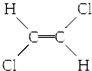 属于位置异构 属于位置异构 | |
| C. | CH2═C(CH3)2和CH3CH═CHCH3属于官能团异构 | |
| D. | CH3CH2CH2COOH和CH3COOCH2CH3属于位置异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1mol甲醇完全燃烧时,转移的电子数为6NA | |
| C. | 标准状况下,22.4L甲烷和22.4L氯仿所具有的微粒数均为NA | |
| D. | 1 L 0.1mol/L醋酸溶液中含有的氢离子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com