
用50 mL 0.50 mol · L-1的盐酸与50 mL 0.55 mol · Lf-1的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。完成下列问题:
(1)烧杯间填满碎泡沫塑料的作用是__________________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?______(填“能”或“不能”),其原因是___________________________________;
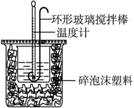
(3)为什么氢氧化钠溶液的浓度要用0.55 mol · L-1?___________________________;
实验中若改用60 mL 0.50 mol · L-1的盐酸与50 mL 0.55 mol · L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”“不相等”),若实验操作均正确,则所求中和热_________(填“相等”“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:_____________________________;
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得的结果偏低,请你分析结果偏低的原因可能是_________(填字母代号)。
a.测量盐酸的温度后,温度计没有用水冲洗干净
b.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
c.做本实验的当天室温较高
d.将50 mL 0.55 mol · L-1的氢氧化钠溶液取成了50 mL 0.55 mol · L-1的氨水
e.在量取盐酸时仰视读数
f.大烧杯的盖板中间小孔太大
(1)减少热量损失
(2)不能 ①铁会和盐酸反应,②铁导热性好,热量损失较大
(3)为了确保盐酸完全被中和 不相等 相等
(4)NaOH(aq) + HCl(aq)==== NaCl(aq) + H2O (l);ΔH=-57.3 kJ· mol-1
(5)abdf
本题是中学化学新增实验,重点考查学生对中和热测定的实验能力,对出现问题的分析和解决能力,热化学方程式的书写、误差分析等。由于本实验的关键是如何防止热量的损失,所以可以填充大量泡沫、使用玻璃搅拌器、稍过量的氢氧化钠等;(3)中由于参加反应的盐酸(60 mL 0.50 mol · L-1)与氢氧化钠(50 mL 0.55 mol · L-1)完全反应后生成的水的物质的量(50 mL 0.55 mol · L-1)比原先(50 mL ×0.50 mol · L-1)多,所以生成的热量多,但中和热不变;(5)中a.测量盐酸的温度后,温度计没有用水冲洗干净,使参加反应的盐酸的量减小,所测定的热量减少,计算的中和热偏低;b .把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓会造成热量损耗而计算结果减小;c .做本实验的当天室温较高,与所测定的热量无影响;d .将50 mL 0.55 mol · L-1的氢氧化钠溶液取成了50 mL 0.55 mol·L-1的氨水,由于氨水为弱电解质,其电离需吸热,导致反应产生的热量小,中和热减小; e.在量取盐酸时仰视读数,使所取盐酸的体积大于50.0 mL,反应放热大,计算时中和热偏高;f.大烧杯的盖板中间小孔太大,热量损失,中和热低。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:038
对牛奶中的蛋白质进行实验:取30.0 mL牛奶,用盖尔达法分解蛋白质,把其中所含的氮元素完全转变为氨,再用50 mL 0.5 mol·![]() 的硫酸溶液充分吸收,剩余的硫酸用1 mol·
的硫酸溶液充分吸收,剩余的硫酸用1 mol·![]() 的氢氧化钠溶液中和,消耗NaOH溶液38.00
mL.
的氢氧化钠溶液中和,消耗NaOH溶液38.00
mL.
求:(1)已知蛋白质中含氮质量分数为16%,求该牛奶中蛋白质的质量分数.(该牛奶的密度是1.03 g·![]() )
)
(2)在250.0 mL牛奶中含蛋白质的质量.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
求:(1)已知蛋白质中含氮质量分数为16%,求该牛奶中蛋白质的质量分数.(该牛奶的密度是1.03 g·![]() )
)
(2)在250.0 mL牛奶中含蛋白质的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
A.用10 mL量筒准确量取稀硫酸溶液8.0 mL
B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.将饱和FeCl3溶液滴入蒸馏水中即得Fe(OH)3胶体
F.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
(2)用50 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液进行中和热的测定实验,请回答下列问题:
①在实验中使用的仪器除大烧杯、小烧杯、环形玻璃搅拌棒、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)外,还必须要用到的仪器有___________________________。
②要想提高中和热测定的准确性,可采用的措施除以下列出的三种以外,请你再写出三种:
a.如果按教材中的方法做,一定要使小烧杯杯口与大烧杯杯口相平。
b.盐酸和NaOH溶液浓度的配制要准确,且NaOH溶液的浓度须稍大于盐酸的浓度。
c.实验操作时动作要快,注意不要将溶液洒到外面。
d.__________________________________________________________。
e.__________________________________________________________。
f.__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
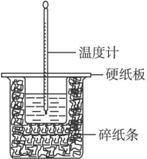
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1的NaOH溶液进行反应,从理论上说所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
三鹿奶粉事件震惊全国,导致了中国奶制品行业危机,其起因是掺假者为了提高奶制品中蛋白质含量而加入了化工原料三聚氰胺(C3N6H6),严重损害了人们的身体健康。测定牛奶中蛋白质含量常用盖达尔法:![]() ,如图所示为某一牛
,如图所示为某一牛
奶的营养成分表,现取30 mL牛奶用盖达尔法分解蛋白质,把氮全部转化为氨,用50 mL 0.5 mol/L的H2SO4吸收,剩余的酸用1 mol/L NaOH溶液中和,需38 mL。
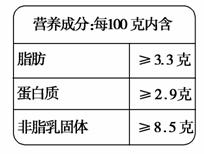
(1)计算30 mL牛奶中共含有多少克氮?
(2)试判断此牛奶中蛋白质含量是否合格(已知牛奶密度为1.3 g·mL-1,蛋白质中含氮的质量分数为16%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com