
分析 5min时测得N2O5转化了20%,可知消耗N2O5的物质的量是4mol×20%=0.8mol,则
2N2O5(g)?4NO2(g)+O2(g)
开始 4 0 0
转化 0.8 1.6 0.4
5min 3.2 1.6 0.4
结合v=$\frac{△c}{△t}$、5min时总物质的量、N2O5的物质的量计算.
解答 解:5min时测得N2O5转化了20%,可知消耗N2O5的物质的量是4mol×20%=0.8mol,则
2N2O5(g)?4NO2(g)+O2(g)
开始 4 0 0
转化 0.8 1.6 0.4
5min 3.2 1.6 0.4
(1)5min时,剩余N2O5的物质的量是4mol-0.8mol=3.2mol,
答:剩余N2O5的物质的量为3.2mol;
(2)生成1.6mol二氧化氮,可知v(NO2)=$\frac{\frac{1.6mol}{2L}}{5min}$=0.16mol/(L•min),
答:v(NO2)为0.16mol/(L•min);
(3)5min时混合气体的总物质的量是3.2+0.4+1.6=5.2mol,N2O5的物质的量占混合气体总物质的量的百分比为$\frac{3.2mol}{5.2mol}$×100%=61.5%,
答:5min时,N2O5的物质的量占混合气体总物质的量的百分比为61.5%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、各物质的量的关系等为解答的关键,侧重分析与计算能力的考查,注意物质的量分数的计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含有的电子数是NA | |
| B. | 常温常压下,4g氦气所含有的原子数目为NA | |
| C. | 标准状况下,1L正戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 容器体 积/L | 平衡时O2转化率 | 平衡时 压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1>p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
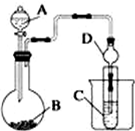 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
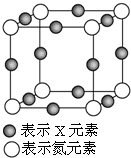 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )
元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )| A. | X元素的原子序数为28 | |
| B. | 晶体中与一个N3-距离最近的Xn+为8个 | |
| C. | Xn+中n的值为1 | |
| D. | 该晶体中N3-与Xn+的个数比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com